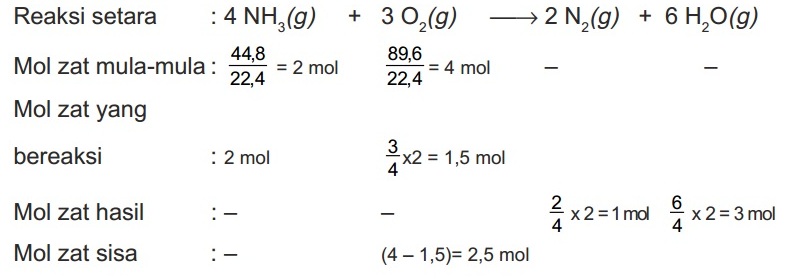Prinsip stoikiometri reaksi umum untuk menemukan mol, massa dan volume zat yang direaksikan dan dihasilkan. Oleh karena itu stoikiometri selalu menerapkan hukum-hukum dasar ilmu kimia sehingga diperlukan pemahaman persamaan reaksi, massa atom relatif, massa molekul relatif, dan juga hubungan mol dengan massa zat dan volume. Perhatikan contoh soal stoikiometri dan pembahasannya berikut ini.
Soal No. 1
Tentukan Mr dari urea (CO(NH2)2)! (Ar C = 12; O = 16; N = 14; H 1)
Pembahasan:
Mr = ∑Ar
Mr = (1 x Ar C) + (1 x Ar O) + (2 x Ar N) + (4 x Ar H)
Mr = (1 x 12) + (1 x 16) + (2 x 14) + (4 x 1)
Mr = 12 + 16 + 28 + 4 = 60
Soal No. 2
Tentukan rumus empiris dari senyawa yang mengandung 59% natrium dan 41% belerang! (Ar Na = 23; S = 32).
Pembahasan:
Perbandingan % massa Na : S = 59% : 41%
Perbandingan jumlah unsur Na : S = (59/23) : (41/32) = 2 : 1
Rumus empiris = Na2S
Soal No. 3
Tentukan rumus empiris dari senyawa yang mengandung 66,3% klor, 26,2% nitrogen, 7,5% hidrogen! (Ar N = 14, H = 1, Cl = 35,5)
Pembahasan:
Perbandingan massa N : H : Cl = 26,2% : 7,5% : 66,3%
Perbandingan jumlah unsur N : H : Cl = (26,2/14) : (7,5/1) : (66,3/35,5)
Perbandingan jumlah unsur N : H : Cl = 1,87 : 7,5 : 1,87
Perbandingan jumlah unsur N : H : Cl = 1 : 4 : 1
Rumus empiris = NH4Cl
Soal No. 4
Tentukanlah jumlah atom besi yang terdapat dalam 0,5 mol besi!
Pembahasan:
Jumlah atom besi = 0,5 mol x 6,02 . 1023 atom/mol = 3,01 . 1023 atom
Soal No. 5
Hitunglah jumlah masing-masing atom yang terdapat di dalam 2 mol H2O.
Pembahasan:
H2O terdiri atas 2 atom H dan 1 atom O
Jumlah atom H = 2 x 2 mol x 6,02 . 1023 atom/mol = 24,08 . 1023 atom
Jumlah atom O = 1 x 2 mol x 6,02 . 1023 atom/mol = 12,04 . 1023 atom
Soal No. 6
Berapa mol karbon monoksida yang mengandung 6,02 . 1021 m0lekul!
Pembahasan:
mol CO = 6,02 . 1021 /6,02 . 1023 = 0,01 mol
Soal No. 7
Berapakah massa dari 2 mol glukosa (C6H12O6)? (Ar C = 12, H = 1, O = 16)
Pembahasan:
Diketahui:
n = 2 mol
Mr C6H12O6 = (6 x Ar C) + (12 x Ar H) + (6 x Ar O)
Ditanyakan: gr C6H12O6 = ….?
Jawaban:
Mr C6H12O6 = (6 x 12) + (12 x 1) + (6 x 16) = 180
n = gr/Mr
2 = gr/180
gr = 2 x 180 = 360 gram
Soal No. 8
Hitung Ar dari X jika 0,2 mol unsur X mempunyai massa 8 gram.
Pembahasan:
Diketahui:
n = 0,2 mol
gr = 8 gram
Ditanyakan: Ar = …?
Jawaban:
n = gr/Ar
Ar = gr/n
Ar = 8/0,2 = 40
Soal No. 9
Berapa volume 3 mol gas hidrogen pada STP?
Pembahasan:
Volume H2 = 3 mol x 22,4L/1mol = 67,2 L
Soal No. 10
Berapa mol gas CO2 yang mempunyai volume 5600 mL?
Pembahasan:
Diketahui:
V = 5600 mL = 5,6 L
Ditanyakan: n = ….?
Jawaban:
n = V/22,4
n = 5,6/22,4 = 0,25 mol
Soal No. 11
Hitung volume 5 mol gas pada tekanan 152 mmHg dan temperature 270C!
Pembahasan:
Diketahui:
n = 5 mol
P = 152 mmHg = 0,2 atm
T = 27 0C = 300 K
Ditanyakan: V = …?
Jawaban:
PV = nRT
0,2 x V = 5 x 0,082 x 300
V = 615 L
Soal No. 12
Diketahui persamaan reaksi:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Jika Mg yang bereaksi adalah 2 mol, hitunglah
- Mol HCl yang bereaksi
- Volume gas H2 yang dihasilkan pada STP
Pembahasan:
Reaksi setara:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
1. Mol HCl yang bereaksi
Perbandingan mol:
- 1 mol Mg sebanding dengan 2 mol HCl
- 2 mol Mg sebanding dengan 4 mol HCl
maka HCl yang bereaksi = 4 mol
2. Volume gas H2 yang dihasilkan pada STP
1 mol Mg sebanding dengan 1 mol H2
2 mol Mg sebanding dengan 2 mol H2
Maka H2 yang dihasilkan = 2 mol
Volume gas H2 pada STP = 2 x 22,4 = 44,8 L
Soal No. 13
Pada saat korek api gas dinyalakan, reaksi yang terjadi adalah:
C4H10(g) + O2(g) → CO2(g) + H2O(g)
Jika pada reaksi itu dihasilkan 88 gram gas CO2. Hitunglah massa C4H10 yang bereaksi! (Ar C = 12, O = 16, H = 1)
Pembahasan:
Jumlah mol CO2 = gr/Mr CO2 = 88/44 = 2 mol
Reaksi setara:
2C4H10 + 13O2 → 8 CO2 + 10H2O
Perbandingan koefisien:
C4H10 : O2 : CO2 : H2O = 2 : 13 : 8 : 10
Jumlah mol C4H10 = (koefisien C4H10/koefisien CO2) x jumlah mol CO2
Jumlah mol C4H10 = (2/8) x 2 = 0,5 mol
gr C4H10 = jumlah mol x Mr = 0,5 x 58 = 29 gram
Jadi, massa C4H10 yang bereaksi = 29 gram.
Soal No. 14
Di dalam bejana tertutup 44,8 L gas NH3 direaksikan dengan 89,6 L gas O2 pada STP dengan reaksi:
4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(g)
Hitunglah
- Volume gas N2 yang dihasilkan
- Volume gas H2O yang dihasilkan
- Volume gas yang tersisa
Pembahasan:
- Volume gas N2 yang dihasilkan = 1 x 22,4 L = 22,4 L
- Volume gas H2O yang dihasilkan = 3 x 22,4 L = 67,2 L
- Volume gas O2 sisa = 2,5 x 22,4 L = 56 L
Soal No. 15
Hitung massa masing-masing unsur dalam 20 gram Fe2(SO4)3. Ar Fe = 56, S = 32, O = 16; Mr Fe2(SO4)3 = 400.
Pembahasan:
Jumlah mol Fe2(SO4)3 = gr/Mr = 20/400 = 0,05 mol
Pada 0,05 mol Fe2(SO4)3 mengandung Fe, S, dan O sebagai berikut.
Fe = 2 x 0,05 x 56 = 5,6 gram
S = 3 x 0,05 x 32 = 4,8 gram
O = 12 x 0,05 x 16 = 9,6 gram