Soal No. 17
Di antara pasangan senyawa di bawah ini, yang berikatan kovalen adalah ….
A. HCl
B. KCl
C. MgF2
D. K2O
E. MgO
Jawaban: C
Pembahasan:
Dari konfigurasi elektron H dan Cl dapat kita peroleh ikatan kovalen tunggal.
1H = 1
17Cl = 2 8 7
Atom H kekurangan 1 elektron untuk mencapai duplet dan atom Cl kekurangan 1 elektron untuk mencapai oktet. Jadi, keduanya saling membutuhkan satu sama lain. Sehingga terjadi pemakaian bersama pasangan elektron yang mengakibatkan terbentuknya ikatan kovalen.
Soal No. 18
Di antara molekul-molekul di bawah ini, yang mempunyai ikatan kovalen rangkap dua adalah ….
A. N2 (nomor atom N = 7)
B. H2 (nomor atom H = 1)
C. O2 (nomor atom O = 8)
D. H2O
E. NH3
Jawaban: C
Pembahasan:
Untuk mengetahui, suatu molekul memiliki ikatan kovalen rangkap 1, 2, atau 3 dapat kita lakukan dengan menuliskan struktur Lewis tiap-tiap molekul.
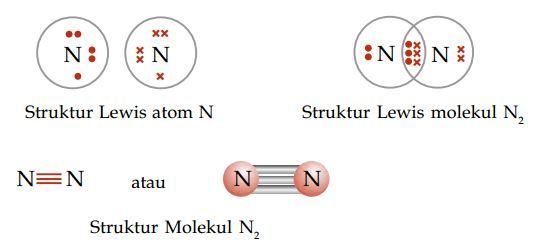
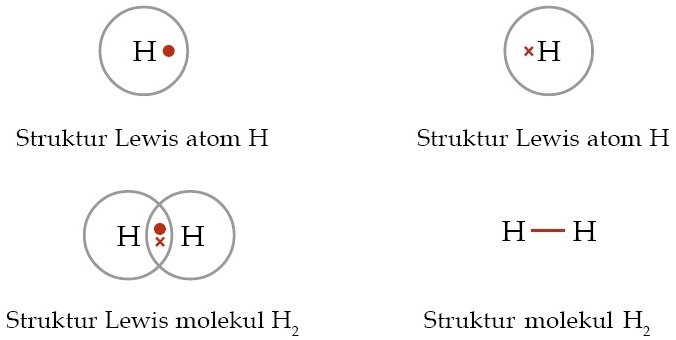
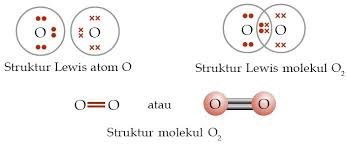
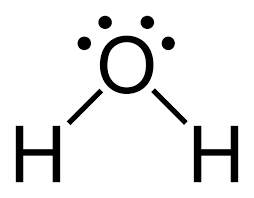
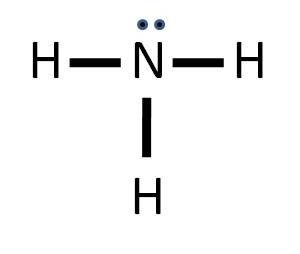
Soal No. 19
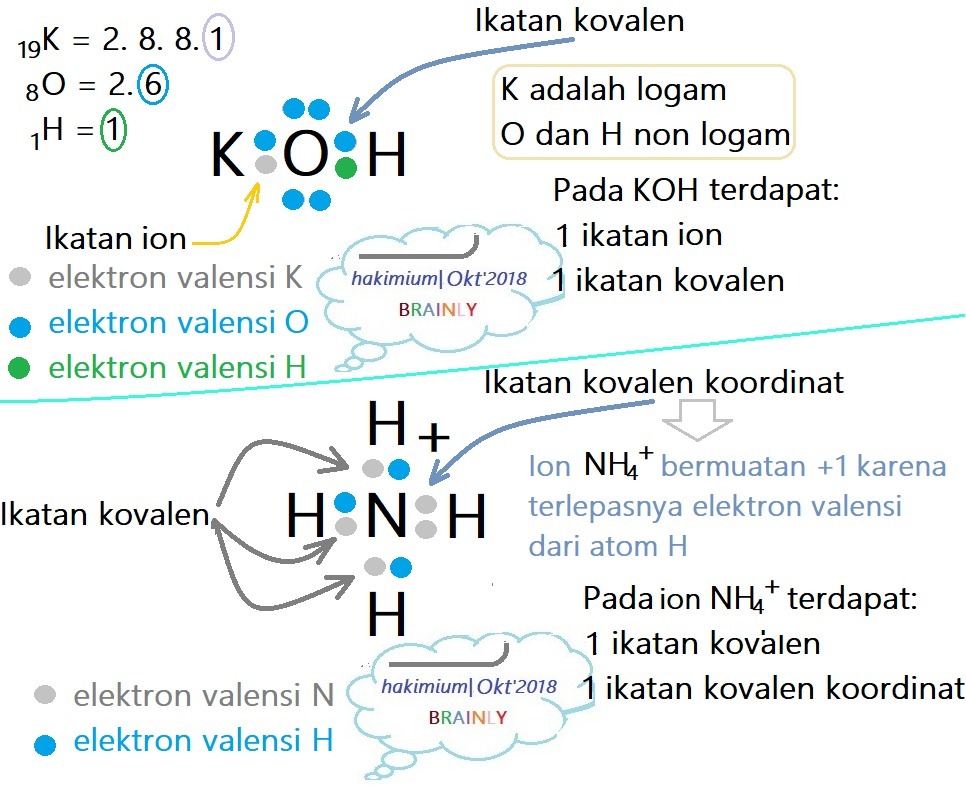
Senyawa dan ion di bawah ini yang mempunyai ikatan kovalen dan ikatan ion sekaligus adalah ….
A. KCl
B. KOH
C. NH4+
D. Cl2O
E. PCl5
Jawaban: B
Pembahasan:
Soal No. 20
Diketahui nilai keelektronegatifan unsur-unsur H, F, Cl, Br, dan I berturut-turut 2,1; 4,0; 3,5; 2,8 dan 2,5. Molekul yang paling polar adalah ….
A. HF
B. HCl
C. HBr
D. HI
E. IF
Jawaban: A
Pembahasan:
Untuk mengetahui tingkat kepolaran suatu senyawa, kita dapat menentukan dengan menghitung selisih atau perbendaan keelektronegatifan unsur-unsur penyusun senyawa tersebut. Semakin besar perbedaan keelektronegatifan unsur-unsur penyusun senyawa maka semakin polar pula senya tersebut.
A. HF = 4,0 – 2,1 = 1,9
B. HCl = 3,5 – 2,1 = 1,4
C. HBr = 2,8 – 2,1 =0,7
D. HI = 2,5 – 2,1 =0,4
E. IF = 4,0 – 2,5 = 1,4
Soal No. 21
Kedudukan elektron-elektron dari atom-atom logam dalam membentuk ikatan logam adalah …
A. Selalu berada di antara dua atom logam yang berikatan dan digunakan secara bersama
B. Masing-masing atom logam memberikan elektron valensinya kepada atom logam yang lain
C. Tidak terikat pada salah satu atom tetapi dapat bergerak bebas sebagai awan elektron
D. Masing-masing elektron valensi berada di antara inti atom logam yang saling berdekatan satu sama lain
E. Terikat pada inti atom logam tertentu sesuai dengan jumlah proton dari atom logam yang bersangkutan
Jawaban: C
Pembahasan:
Pada ikatan logam, elektron valensi bergerak sangat bebas, terdelokalisasi, dan tidak terikat dengan atom tertentu. Hal ini dikenal sebagai lautan elektron. Karakter elektron-elektron pada ikatan logam tersebut semakin menegaskan sifat daya hantar listrik dan panas serta kemampuan logam untuk dapat ditempa.
Soal No. 22
Berikut ini yang merupakan sifat logam berkaitan dengan ikatan yang terjadi pada logam adalah ….
A. Daya hantar listrik dan panas dari logam sangat baik
B. Massa jenis logam sangat besar dan keras
C. Logam mudah melespaskan elektron valensinya
D. Mudah membentuk ikatan ion dengan unsur non-logam
E. Titik didih dan titik lebur logam sangat rendah
Jawaban: A
Pembahasan:
Adanya elektron yang dapat bergerak bebas dari satu atom ke atom yang lain menjadikan logam sebagai penghantar listrik dan kalor yang baik
Soal No. 23
Gaya van der Waals yang paling besar terdapat pada molekul ….
A. CO2
B. CO
C. SO3
D. NO
E. NO2
Jawaban: E
Pembahasan:
Gaya van der Waals terjadi antarmolekul polar dimana molekul polar memiliki ujung-ujung yang muatannya berlawanan. Ketika dikumpulkan, maka molekul polar akan membentuk formasi sedemikian rupa sehingga ujung yang bermuatan positif akan berdekatan dengan ujung yang bermuatan negatif dari molekul lain dengan formasi yang tidak tetap karena molekul selalu bergerak dan bertumbukan.
Soal No. 24
Diketahui skala keelektronegatifan unsur H = 2,1; O = 3,5; C = 2,5; N = 3,0; dan Cl = 3,0. Molekul berikut yang paling polar adalah ….
A. NH3
B. H2O
C. CH4
D. HCl
E. H2
Jawaban: B
Pembahasan:
Molekul polar ditandai dengan adanya perbedaan keelektronegatifan, semakin besar perbedaan keelektronegatifannya maka semakin polar juga molekul tersebut. Sedangkan molekul non polar tidak mempunyai perbedaan keelektronegatifan.
A. NH3 → (N = 3) (H = 2,1) → 3 – 2,1 = 0,9
B. H2O → (H = 2,1) (O = 3,5) → 3,5 – 2,1 = 1,4
C. CH4 → (C = 2,5) (H = 2,1) → 2,5 – 2,1 = 0,4
D. HCl → (H = 2,1) (Cl = 3) → 3 – 2,1 = 0,9
E. H2 → (H = 2,1) (H = 2,1) → 2,1 – 2,1 = 0
Jadi, molekul yang paling polar adalah H2O karena memiliki perbedaan keelektronegatifan yang paling besar.
Soal No. 25
Di antara molekul-molekul di bawah ini yang merupakan molekul non-polar adalah ….
A. CHCl3
B. HCl
C. BCl3
D. CH3Cl
E. NH3
Jawaban: C
Pembahasan:
Karena molekul BCl3 tidak mempunyai PEB