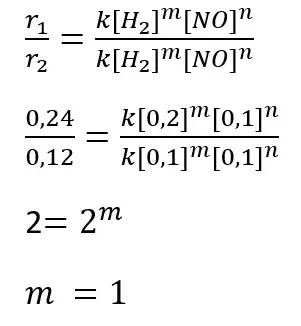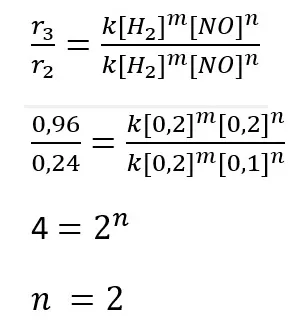Orde reaksi suatu reaksi kimia memberikan gambaran mengenai besarnya pengaruh konsentrasi reaktan terhadap laju reaksi kimia. Kebanyakan orde reaksi bernilai 1 atau 2, tetapi ada juga yang bernilai pecahan bahkan nol.
Jika orde suatu reaktan bernilai nol, artinya konsentrasi reaktan tersebut tidak mempengaruhi laju reaksi. Jika nilai orde reaksi terhadap suatu reaktan semakin besar, maka semakin besar pula pengaruh konsentrasi reaktan tersebut terhadap laju reaksi.
Untuk mencari orde reaksi dapat dilakukan dengan cara membandingkan laju reaksi dari masing-masing data hasil eksperimen. Karena orde reaksi tidak dapat ditentukan dari koefisien reaktan melainkan harus ditentukan melalui percobaan.
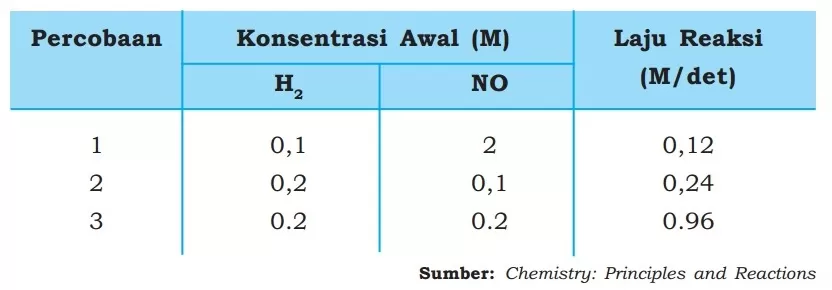
Contoh, pada percobaan penentuan laju reaksi antara gas hidrogen (H2) dengan nitrogen oksida (NO) pada suhu 800°C diperoleh data sebagai berikut.
Berdasarkan data percobaan tersebut, kita dapat mencari orde reaksi terhadap H2 dan juga NO. Orde reaksi terhadap H2 ditentukan dari harga konsentrasi NO yang dibuat konstan, sedangkan orde reaksi terhadap NO ditentukan dari konsentrasi H2 yang dibuat konstan.
Kita misalkan persamaan laju reaksi adalah
r = k [H2]m[NO]n
Jadi, dari data tersebut, orde reaksi terhadap H2 ditentukan dengan membandingkan laju reaksi yang diperoleh dari percobaan 1 dan 2, yaitu sebagai berikut.
Dari hasil perhitungan tersebut didapatkan orde reaksi terhadap H2 adalah 1. Orde reaksi terhadap NO ditentukan dengan membandingkan laju reaksi yang diperoleh dari percobaan 2 dan 3, yaitu sebagai berikut.
Jadi, dari hasil perhitungan tersebut didapatkan orde reaksi terhadap NO adalah 2.
Untuk mencari orde reaksi total dapat kita jumlah orde reaksi H2 dan orde reaksi NO sehingga didapatkan,
orde reaksi total = orde reaksi H2 + orde reaksi NO = 1 + 2 = 3.
Jadi, orde reaksi totalnya adalah 3.