Soal UN Kimia 2019 No. 1
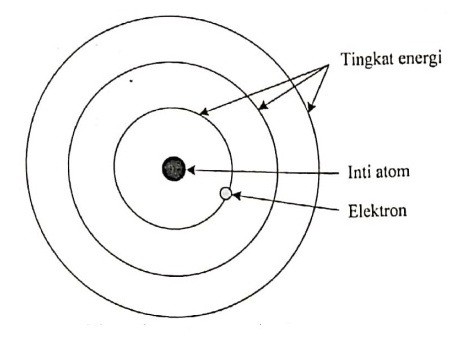
Perhatikan gambar dan beberapa pernyataan tentang model atom berikut!
- Tidak dapat menjelaskan spektra atom hidrogen.
- Tidak dapat menerangkan pengaruh medan magnet terhadap spektrum atom.
- Tidak dapat menjelaskan tingkat-tingkat energi atom hidrogen.
- Tidak dapat menerangkan struktur atom berelektron banyak.
Pasangan pernyataan yang benar tentang kelemahan model atom tersebut adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Jawaban: D
Pembahasan:
Model atom di atas merupakan model atom Bohr. Kelemahan model atom Bohr yaitu:
- Melanggar asas ketidakpastian Heisenberg karena elektron mempunyai jari-jari dan lintasan yang telah diketahui
- Model atom Bohr mempunyai nilai momentum sudut lintasan ground state yang salah
- Lemahnya penjelasan tentang prediksi spektra atom yang lebih besar.
- Tidak dapat memprediksi intensitas relatif garis spektra.
- Model atom Bohr tidak dapat menjelaskan struktur garis spektra yang baik.
- Tidak dapat menjelaskan efek Zeeman. Efek Zeeman adalah pemisahan sebuah garis spektrum menjadi beberapa komponen disebabkan oleh adanya medan magnet.
Soal UN Kimia 2019 No. 2
Massa rata-rata satu atom P adalah 6,64 x 10-23 gram, sedangkan massa satu atom karbon C-12 adalah 1,992 x 10-23 gram. Massa atom relatif (Ar) untuk unsur P adalah …
Jawaban: C
Pembahasan:
Diketahui:
Massa rata-rata satu atom P adalah 6,64 x 10-23 gram
massa satu atom karbon C-12 adalah 1,992 x 10-23 gram
Ditanyakan: Ar P = ….?
Jawaban:
Soal UN Kimia 2019 No. 3
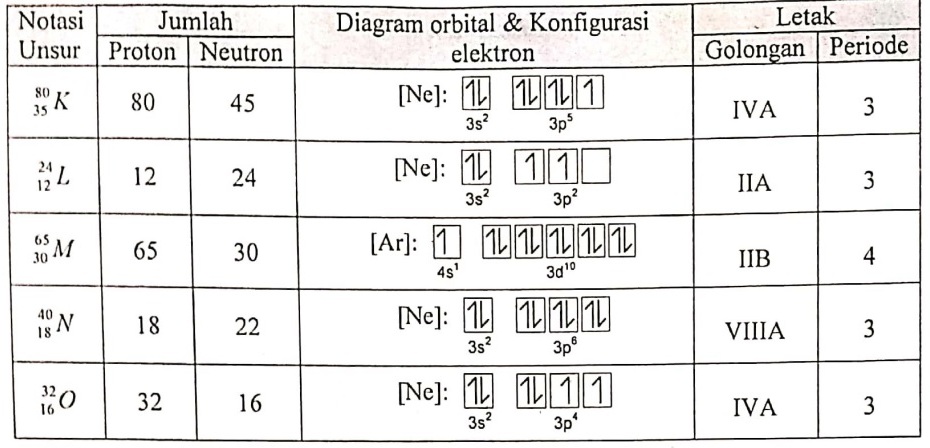
Perhatikan hubungan notasi unsur, konfigurasi elektron, dan letaknya dalam tabel periodik unsur berikut!
Data yang berhubungan dengan tepat ditunjukkan oleh notasi unsur ….
A. K
B. L
C. M
D. N
E. O
Jawaban: D
Pembahasan:
Pada atom netral,
Jumlah Proton = Jumlah Elektron
Pada tabel diatas, yang memiliki jumlah proton dan jumlah elektron sama terdapat pada unsur L dan unsur N. Namun, pada unsur L konfigurasi elektronnya salah. Harusnya cukup sampai 3s2. Sehingga unsur L salah.
Beda halnya dengan unsur N. Elektronnya berjumlah 18, sehingga konfigurasi elektronnya terlihat seperti di tabel.
Soal UN Kimia 2019 No. 4
Unsur Y termasuk unsur transisi dan memiliki notasi 52Y24. Konfigurasi elektron Y pada keadaan dasar adalah ….
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d4
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d5
C. 1s2 2s2 2p6 3s2 3p6 3d6
D. 1s2 2s2 2p6 3s2 3p6 4s0 4p4
E. 1s2 2s2 2p6 3s2 3p6 4s0 4d5
Jawaban: A
Pembahasan:
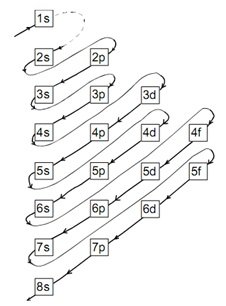
Pengisian elektron dalam konfigurasi elektron didasarkan pada acuan berikut:
Karena masih dalam keadaan dasar, maka konfigurasi elektron Y adalah sebagai berikut:
1s2 2s2 2p6 3s2 3p6 4s2 3d4
Namun, apabila dalam keadaan tereksitasi, maka konfigurasi elektron Y adalah sebagai berikut:
1s2 2s2 2p6 3s2 3p6 4s1 3d5
Soal UN Kimia 2019 No. 5
Proses industri pembuatan amonia dapat dibuat dari reaksi antara gas nitrogen dan hidrogen, dengan persamaan reaksi:
N2(g) + H2(g) → NH3(g) ∆H = -92,4 kJ
Reaksi berlangsung pada suhu dan tekanan tinggi dengan menggunakan katalisator serbuk Fe dicampur dengan Al2O3, MgO, CaO, dan K2O. Perbandingan volume gas-gas yang bereaksi dan hasil reaksi pada P dan T yang sama ternyata 1 : 3 dan 2. Berdasarkan wacana tersebut, hukum kimia yang berlaku adalah ….
A. Hukum Dalton
B. Hukum Gay-Lussac
C. Hukum Avogadro
D. Hukum Lavoisier
E. Hukum Proust
Jawaban: B
Pembahasan:
Hukum Gay Lussac berbunyi “Pada suhu dan tekanan yang sama, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana”.
Reaksi kimia:
N2(g) + H2(g) → NH3(g)
Apabila kita setarakan, maka akan menghasilkan reaksi kimia sebagai berikut:
N2(g) + 3H2(g) → 2NH3(g)
Sehingga menghasilkan perbandingan 1 : 3 dan 2.