Soal UN Kimia 2019 No. 21
Suatu larutan glukosa (Mr = 180) dilarutkan dalam 100 gram air dan mendidih pada suhu 100,650C. Jika Kb air = 0,520C kg/mol, massa glukosa yang dilarutkan adalah ….
A. 5,6 gram
B. 11,2 gram
C. 22,5 gram
D. 45,0 gram
E. 67,5 gram
Jawaban: C
Pembahasan:
Diketahui:
Mr glukosa = 180
p = 100 gram
Kb air = 0,520C kg/mol
∆tb = 100,650C – 1000C = 0,650C
Ditanyakan: massa glukosa = ….?
Jawaban:
∆tb = Kb x (gr/Mr) x (1000/p)
0,65 = 0,52 x (gr/180) x (1000/100)
5,2 x gr = 180 x 0,65
gr = 22,5 gram
Soal UN Kimia 2019 No. 22
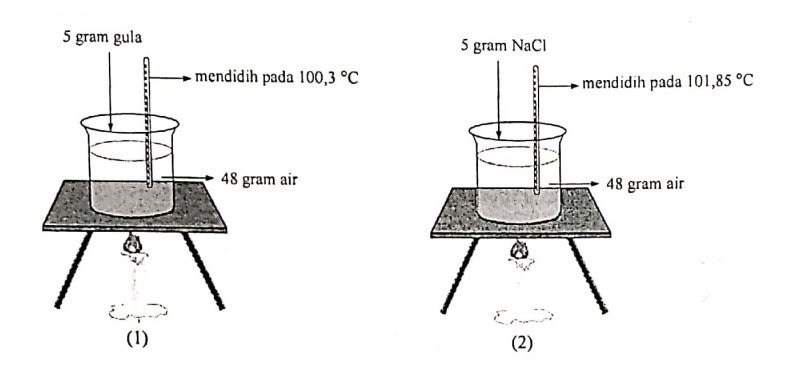
Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut!
Jika Mr NaCl = 58,5, Mr glukosa = 180 dan Tb air = 1000C, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah ….
A. 0,520C/molal
B. 0,540C/molal
C. 0,550C/molal
D. 0,560C/molal
E. 0,570C/molal
Jawaban: A
Pembahasan:
Diketahui:
Mr NaCl = 58,5
Mr gula = 180
Tb air = 1000C
gr gula = 5 gram
gr NaCl = 5 gram
p = 48 gram
∆tb gula = 100,30C – 1000C = 0,30C
∆tb NaCl = 101,850C – 1000C = 1,850C
Ditanyakan: Kb = ….?
Jawaban:
Kb dalam larutan gula
∆tb = Kb x (gr/Mr) x (1000/p)
0,3 = Kb x (5/180) x (1000/48)
Kb = (0,3 x 180 x 48)/(5 x 1000)
Kb = 0,520C/molal
Kb dalam larutan NaCl
∆tb = Kb x (gr/Mr) x (1000/p) x i
1,85 = Kb x (5/58,5) x (1000/48) x 2
Kb = (1,85 x 58,5 x 48)/(5 x 1000 x 2)
Kb = 0,520C/molal
Soal UN Kimia 2019 No. 23
Perhatikan beberapa larutan garam dengan konsentrasi sama berikut!
- Kalsium karbonat
- Barium klorida
- Besi (III) klorida
- Aluminium sulfat
- Kalium nitrat
Larutan garam yang mempunyai titik beku paling rendah adalah ….
A. 1
B. 2
C. 3
D. 4
E. 5
Jawaban: D
Pembahasan:
Karena semua larutan garam tersebut mengandung konsentrasi yang sama, maka titik beku larutan hanya bergantung pada jumlah partikel. Sehingga,
∆tf = i
Nilai i untuk setiap senyawa yaitu:
Kalsium karbonat (CaCO3) nilai i = 2
Barium klorida (BaCl2) nilai i = 3
Besi (III) klorida (FeCl3) nilai i = 4
Aluminium sulfat (Al2(SO4)3) nilai i = 5
Kalium nitrat (KNO3) nilai i = 2
Rumus titik beku yaitu:
tf = 0 – ∆tf
Itu artinya, apabila nilai ∆tf besar maka nilai tf kecil.
Jadi, larutan garam yang mempunyai titik beku paling rendah adalah aluminium sulfat (Al2(SO4)3).
Soal UN Kimia 2019 No. 24
Bilangan oksidasi belerang dalam aluminium sulfat Al2(SO4)3 dan ion SO32- berturut-turut adalah ….
A. -4 dan +4
B. -2 dan +2
C. +2 dan +3
D. +4 dan +2
E. +6 dan +4
Jawaban: E
Pembahasan:
Al2(SO4)3 → 2Al3+ + 3SO42-
Bilangan oksidasi Al = +3
Bilangan oksidasi O = -2
Bilangan oksidasi SO42- = -2
Bilangan oksidasi SO32- = -2
Bilangan oksidasi S dari ion SO42-
SO42- = S + 4(O)
-2 = S + 4(-2)
S = 8 – 2 = +6
Bilangan oksidasi S dari SO32-
SO32- = S + 3(O)
-2 = S + 3(-2)
S = 6 – 2 = +4
Soal UN Kimia 2019 No. 25
Baterai nikel-kadmium (nikad) merupakan baterai isi ulang pertama dan yang paling murah sehingga banyak digunakan pada mainan anak-anak dan berbagai gawai. Reaksi yang terjadi pada baterai digunakan:
Cd(s) + NiO2(aq) + 2H2O(l) ⇌ Cd(OH)2(s) + Ni(OH)2(s)
Spesi kimia yang bertindak sebagai reduktor pada saat baterai digunakan adalah …
A. Cd, karena mengalami kenaikan bilangan oksidasi
B. NiO2, karena mengalami kenaikan bilangan oksidasi
C. H2O, karena mengalami kenaikan bilangan oksidasi
D. Cd, karena mengalami penurunan bilangan oksidasi
E. NiO2, karena mengalami penurunan bilangan oksidasi
Jawaban: A
Pembahasan:
Reaksi perubahan bilangan oksidasi:
Dapat kita lihat pada reaksi di atas, Cd mengalami kenaikan bilangan oksidasi sehingga Cd bertindak sebagai reduktor. Sedangkan NiO2 mengalami penurunan bilangan oksidasi sehingga NiO2 bertindak sebagai oksidator.