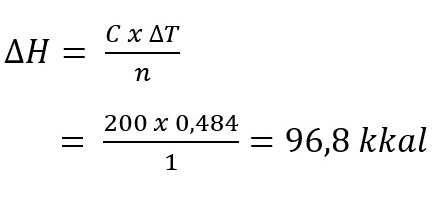Penentuan perubahan entalpi dengan kalorimeter merupakan cara sederhana untuk menentukan perubahan entalpi dengan menggunakan satuan kalori. Aggar lebih jelas perhatikan contoh soal menentukan perhitungan entalpi dengan kalorimeter berikut ini.
Soal No. 1
Dalam suatu eksperimen, didapati 50 mL larutan KOH 1 M pada suhu 30,50C bereaksi dengan 50 mL asam asetat 1 M pada suhu 29,50C. Pada reaksi tersebut suhu campuran menjadi 26,50C. Berdasarkan data tersebut hitung kalor penetralannya dan tulis reaksi yang terjadi (diketahui kapasitas jenis kalorimeter adalah 4,2 J/gr 0C.
Pembahasan:
Persamaan reaksi:
KOH(aq) + CH3COOH(aq) → CH3COOK(aq) + H2O(l)
Jumlah mol asam asetat = M x V : 1000 = 1 x 50 : 1000 = 0,05 mol
Jumlah mol KOH = M x V : 1000 = 1 x 50 : 1000 = 0,05 mol
Suhu rata-rata larutan sebelum bereaksi adalah
T awal = (30,5 + 29,5) : 2 = 30 0C
T akhir = 36,50C
∆T = 36,5 – 30 = 6,50C
Q = m x C x ∆T
Q = (50 + 50) x 4,2 x 6,5 = 2730 J
Kalor penetralan = 2730/0,05 = 54600 J/mol
Soal No. 2
Sebanyak 2 gram naftalena (C10H8), zat yang berbau tajam dan biasa digunakan untuk mengusir ngengat, dibakar dalam kalorimeter bom. Dari hasil pengamatan, suhu air dalam kalorimeter naik sebesar 50C. Jika kapasitas kalor kalorimeter adalah 10,17 kJ/0C, tentukan perubahan entalpi pada reaksi tersebut!
Pembahasan:
Diketahui:
gr = 2 gram
Mr = 128
Jumlah mol = gr/Mr = 2/8 mol = 0,25 mol
C = 10,17 kJ/0C
∆T = 50C
Ditanyakan: ∆H = …?
Jawaban:
Q reaksi = – Q kalorimeter
Q reaksi = – ( C x ∆T)
Q reaksi = – (10,17 x 5) = -50,85 kJ
∆H = (1/0,25 mol) x -50,85 kJ = -203,4 kJ/mol
Soal No. 3
Pada perubahan dari 12,425 gram karbon menjadi CO2 pada suhu reaksi semula 300C, terjadi kenaikan suhu sebesar 0,4840C. Apabila panas jenis calorimeter 200 kkal/gr0C. Berapa ∆H tiap mol karbon yang dibakar?
Pembahasan:
Reaksi:
C + O2 → CO2
n C = 12,435/12 = 1,03 mol
Soal No. 4
Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50 gram alcohol dan 3 gram logam natrium. Jika suhu awal campuran 300C dan setelah reaksi suhunyya 750C, tentukan ∆H reaksi. Diketahui kalor jenis larutan 3,65 J/g0C, kapasitas calorimeter 150 J/0C dan suhu calorimeter naik sebesar 100C.
Pembahasan:
Q larutan = m x c x ∆T = 53 x 3,65 x 45 = 8.705,25 J
Q calorimeter = c x ∆T = 150 x 10 = 1.500 J
Q reaksi + Q larutan + Q calorimeter = 0
Q reaksi + 8.705,25 J + 1.500 J = 0
Q reaksi = – 10.205,25 J
Q reaksi = ∆H reaksi = -10.205,25 J
Soal No. 5
Ke dalam kalorimeter dituangkan 50 gram air dingin 250C, kemudian ditambahkan 75 gram air panas 600C sehingga suhu campuran menjadi 350C. Jika suhu kalorimeter naik sebesar 70C, tentukan kapasitas kalor kalorimeter? Diketahui kalor jenis air = 4,18 J.g-1.0C-1.
Pembahasan:
Q air panas = m x c x ∆T = 75 x 4,18 x (35 – 60) = – 7.837,5 J
Q air dingin = m x c x ∆T = 50 x 4,18 x (35 – 25) = + 2.090 J
Q calorimeter = c x ∆T = (c x 70C)
Q air panas + Q air dingin + Q calorimeter = 0
-7.837,5 + 2.090 + (c x 70C)= 0
-5.747,5 + c x 70C = 0
(c x 70C) = 5.747,5 J
c = 5.747,5/7 = 821 J/0C