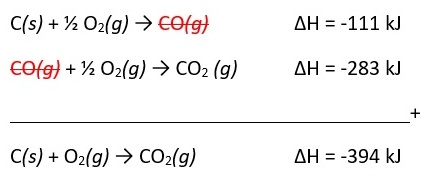Perubahan entalpi pembentukan standar (∆Hf) adalah perubahan entalpi setiap mol senyawa yang terbentuk dalam suatu reaksi kimia pada kondisi standar. Perhatikan contoh soal entalpi pembentukan standar dan pembasannya berikut ini untuk lebih memahami entalpi pembentukan standar.
Soal No. 1
Entalpi pembentukan standar gas ammonia (NH3) adalah -46,11 kJ/mol. Hitung ∆H untuk reaksi berikut.
2/3 NH3(g) → 1/3 N2(g) + H2(g)
Pembahasan:
Reaksi pembentukan gas amonia:
½ N2(g) + 3/2 H2(g) → NH3 (g) ∆H = -46,11 kJ/mol
Reaksi penguraian gas amonia:
2/3 NH3(g) → 1/3 N2(g) + H2(g)
Karena reaksinya dibalik, maka ∆H bernilai positif
∆H = +46,11 kJ/mol x 2/3
∆H = +30,74 kJ/mol
Soal No. 2
Tentukan perubahan entalpi pada reaksi antara karbon monoksida (CO) dengan hydrogen (H2) untuk menghasilkan methanol (CH3OH)!
Pembahasan:
Persamaan reaksi:
CO(g) + 2H2(g) → CH3OH(l)
Dari data ∆H0f diketahui:
∆H0f CO = -111 kJ/mol
∆H0f H2 = 0
∆H0f CH3OH = -239 kJ/mol
Maka,
∆HR = ∆H produk – ∆H reaktan
∆HR = (CH3OOH) – (CO + 2H2)
∆HR = -239 – (-111 + 2 (0))
∆HR = -239 + 111 – 0 = -128 kJ/mol
Soal No. 3
Tentukan perubahan entalpi pembentukan gas SO3 jika diketahui:
S(s) + O2(g) → SO2(g) ∆H = -296,8 kJ
SO2(g) + ½ O2(g) → SO3(g) ∆H = -99,2 kJ
Pembahasan:
Soal No. 4
Diketahui:
H2O2(l) → H2O(l) + ½ O2(g) ∆H = -98,0 kJ
2H2(g) + O2(g) → 2H2O(l) ∆H = -571,6 kJ
Tentukan ∆H reaksi H2(g) + O2(g) → H2O2(l) dengan menggunakan kedua reaksi tersebut!
Pembahasan:
jadi, ∆H reaksi H2(g) + O2(g) → H2O2(l) sebesar -187,8 kJ.
Soal No. 5
Hitung ∆H pembentukan etana dalam reaksi: C2H4(g) → C2H6(g) dengan menggunakan reaksi pembakaran berikut ini.
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(l) ∆H = -1401 kJ
C2H6(g) + 3 ½ O2(g) → 2CO2(g) + 3H2O(l) ∆H = -1550 kJ
H2(g) + ½ O2(g) → H2O(l) ∆H = -286 kJ
Pembahasan:
Jadi, ∆H pembentukan etana sebesar -137 kJ.
Soal No. 6
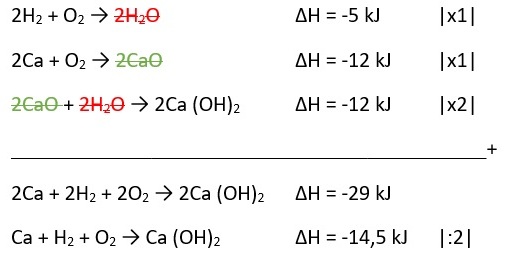
Diketahui data sebagai berikut:
2H2 + O2 → 2H2O ∆H = -5 kJ
2Ca + O2 → 2CaO ∆H = -12 kJ
CaO + H2O → Ca(OH)2 ∆H = -6 kJ
Tentukan ∆H dari reaksi pembentukan Ca(OH)2!
Pembahasan:
Jadi, ∆H dari reaksi pembentukan Ca(OH)2 adalah -14,5 kJ
Soal No. 7
Diketahui persamaan termokimia
C(s) + ½ O2(g) → CO(g) ∆H = -111 kJ
CO(g) + ½ O2(g) → CO2 (g) ∆H = -283 kJ
Tentukan perubahan entalpi standar pembentukan gas CO2!
Pembahasan:
Jadi, nilai perubahan entalpi standar pembentukan gas CO2 sebesar -394 kJ.
Soal No. 8
Tuliskan persamaan termokimia untuk reaksi pembentukan NH4Cl bila diketahui ∆H0f NH4Cl = -120 kJ/mol!
Pembahasan:
½ N2(g) + 2H2(g) + ½ Cl2(g) → NH4Cl(s) ∆H0f = -120 kJ/mol
Soal No. 9
Tuliskan persamaan termokimia pembentukan CaCO3, yang membebaskan kalor sebesar 224 kJ!
Pembahasan:
Ca(s) + C(s) + 3/2 O2(g) → CaCO3(s) ∆H0f = -224 kJ/mol
Soal No. 10
Pada pembentukan 22 gram C3H8 (Ar C = 12, H = 1) dibebaskan kalor sebesar 75 kJ. Tuliskan persamaan termokimia pembentukan C3H8!
Pembahasan:
Jumlah mol C3H8 = gr/Mr = 22/44 = 0,5 mol
∆H0f pembentukan 0,5 mol C3H8 = 0,5 x (-75 kJ) = -150 kJ
Persamaan termokimia pembentukan C3H8:
3C(s) + 4H2(g) → C3H8(s) ∆H0f = -150 kJ/mol