3. Afinitas Elektron
Afinitas elektron adalah nergi yang digunakan atom untuk menerima elektron. Afinitas elektron terbagi menjadi dua, yaitu afinitas elektron negatif dan afinitas elektron positif:
- Afinitas elektron negatif menentukan penerimaan elektron disertai pembebasan energi yang mengakibatkan ion lebih stabil dari atom netralnya dan semakin lebih mudah menerima elektron.
- Afinitas elektron positif menentukan penerimaan elektron disertai penyerapan energi yang mengakibatkan ion kurang stabil dari atom netralnya dan semakin sulit menerima elektron.
Kecenderungan afinitas elektron dalam tabel periodik adalah sebagai berikut:
- Dalam satu golongan, semakin ke bawah, harga afinitas elektron semakin kecil, karena jari – jari atom semakin besar dan gaya tariknya semakin kecil.
- Dalam satu periode, semakin ke kanan, harga afinitas elektron semakin besar, karena jari – jari atom semakin kecil dan gaya tariknya semakin kecil.
Akan tetapi, harga afinitas elektron dalam tabel periodik unsur mengalami penyimpangan pada golongan IIA dan VIIIA, karena lebih positif dibandingkan golongan disebahnya.
Contoh Afinitas Elektron Beberapa Unsur (kJ/mol)
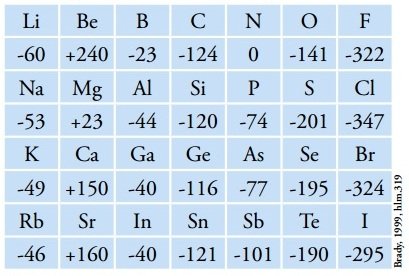
Harga afinitas elektron dinyatakan dalam satuan kJ/mol atau ev. Pada tabel periodik unsur, afinitas elektron terbesar dimiliki oleh unsur klor (Cl) dan terkecil dimiliki oleh unsur berilium (Be).
4. Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom untuk menerima elektron.
- Dalam satu golongan, semakin ke bawah sifat keelektronegatifan semakin kecil, karena jari – jari atom semakin besar dan gaya tariknya semakin kecil.
- Dalam satu periode, semakin ke kanan sifat keelektronegatifan semakin besar, karena jari – jari atom semakin kecil dan gaya tariknya semakin besar.
Contoh Harga Keelektronegatifan Beberapa Unsur (Skala Pauling)

Keelektronegatifan dinyatakan dalam Skala Pauling, di mana harga keelektronegatifan yang terbesar diberi skala 4,0 dan yang terkecil diberi skala 0,7. Pada tabel periodik unsur, harga keelektronegatifan terbesar dimiliki oleh atom Fluorin (F) dan yang terkecil dimiliki oleh Fransium (Fr).
5. Kelogaman (Keelektropositifan)
Kelogaman adalah sifat keelektropositifan suatu unsur yang bergantung pada energi ionisasi. Kecenderungan sifat keelektropositifan dalam tabel periodik unsur:
- Dalam satu golongan, semakin ke bawah sifat kelogamannya semakin bertambah.
- Dalam satu periode, semakin ke kanan sifat kelogamnnya semakin berkurang.
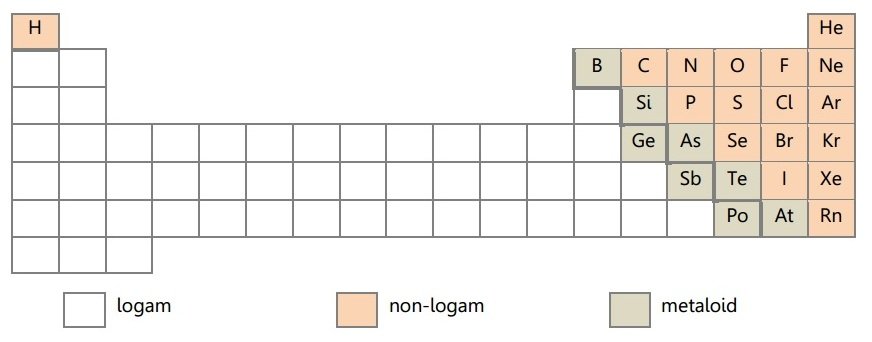
Pada tabel periodik, sifat kelogaman suatu dibatasi dengan garis pembatas berbentuk tangga yang tersusun dari unsur – unsur metaloid. Seperti pada tabel berikut:
6. Titik Leleh dan Titik Didih
Titik leleh dan titik didih merupakan titik dimana suatu unsur mulai berubah wujud menjadi wujud lain.
Pada golongan IA – IVA, semakin ke bawah titik leleh dan titik didih semakin berkurang dan semakin ke kanan (dalam satu periode) semakin bertambah.
Pada golongan VA – VIIIA, semakin ke bawah titik leleh dan titik didih semakin bertambah dan semakin ke kanan semakin berkurang.
Titik leleh dan titik didih terbesar dimiliki oleh atom karbon (C) dan terkecil dimiliki oleh helium (He).