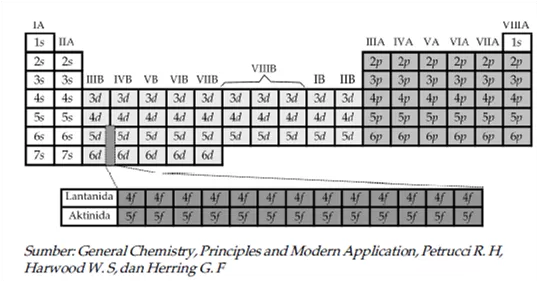
Berdasarkan konfigurasi elektron dan diagram orbital unsur-unsur dalam tabel periodik dibagi menjadi 5 golongan yang terdiri dari golongan utama, gas mulia, unsur transisi, lantanida, dan aktinida. Unsur golongan utama adalah unsur-unsur yang berada dalam golongan 1A-7A, yang semua unsurnya memiliki subkulit s dan/atau p yang belum terisi penuh.
Unsur gas mulia adalah unsur-unsur yang berada dalam golongan 8A yang semua unsurnya memiliki subkulit p yang telah terisi penuh kecuali He yang hanya memiliki subkulit s yang telah terisi penuh.
Unsur transisi adalah unsur-unsur yang terletak dalam golongan 1B, 3B, 4B, 5B, 6B, 7B, dan 8B, diamana setiap unsurnya memiliki subkulit d yang belum terisi penuh.
Sedangkan lantanida dan aktinida adalah unsur-unsur yang memiliki subkulit f yang belum terisi penuh atau bisa disebut sebagai unsur transisi blok-f.
Untuk dapat menentukan golongan suatu unsur dalam tabel periodik berdasarkan konfigurasi elektron, kita harus melihat jenis dan jumlah elektron valensi yang menempati kulit yang sama.
Jadi, jika jumlah elektron luar yang mengisi orbital dalam subkulit sama dengan bilangan kuantum utama, maka atom tersebut pasti terletak pada golongan yang sama.
Sedangkan bilangan kuantum utama (n) yang tersebar menunjuk nomor periode unsur tersebut ke dalam tabel periodik unsur. Pembagian unsur-unsur berdasarkan orbital s, p, d, f dapat digambarkan sebagai berikut.