Ada empat faktor yang mempengaruhi pergeseran arah kesetimbangan kimia, yaitu:
1. Pengaruh Perubahan Konsentrasi Terhadap Kesetimbangan
Perhatikan reaksi pembentukan gas ammonia berikut:
N2(g) + 3H2(g) ⇄ 2NH3(g) H-92kJ
| Aksi yang Diberikan | Arah Pergeseran |
| N2 Ditambah | Ke Kanan (produk bertambah) |
| N2 Dikurangi | Ke Kiri (produk berubah menjadi reaktan) |
| H2 Ditambah | Ke kanan (produk bertambah) |
| H2 Dikurangi | Ke kiri (produk berubah menjadi reaktan) |
| NH3 Ditambah | Ke kiri (produk berubah menjadi reaktan) |
| NH3 Dikurangi | Ke kanan (produk bertambah) |
Jika konsentrasi salah satu zat ditambah, maka sistem akan bergeser dari arah zat tersebut. Jika konsentrasi salah satu zat dikurangi, maka pergeseran arah kesetimbangan sistem akan bergeser ke arah zat tersebut.
2. Pengaruh Perubahan Suhu Terhadap Kesetimbangan
Secara kualitatif pengaruh suhu dalam pergeseran arah kesetimbangan kimia terkait langsung dengan jenis reaksi eksoterm atau reaksi endoterm. Reaksi eksothermis adalah reaksi yang bersifat spontan, tidak memerlukan energi melainkan justru menghasilkan energi (H reaksi negatif), sedangkan reaksi endothermis adalah reaksi yang membutuhkan energi/kalor untuk bisa bereaksi (H positif).
Sistem kesetimbangan yang bersifat eksothermis ke arah kanan dan endothermis ke arah kiri. Jika suhu dinaikkan, maka reaksi akan bergeser ke kiri yaitu reaksi yang bersifat endothermis. Sebaliknya bila suhu diturunkan maka reaksi akan bergeser ke kanan yaitu reaksi yang bersifat eksothermis.
Menaikkan suhu, sama artinya kita meningkatkan kalor atau menambah energi ke dalam sistem, kondisi ini memaksa kalor yang diteri sistem akan dipergunakan, oleh sebab itu reaksi semakin bergerak menuju arah reaksi endoterm. Begitu juga sebaliknya.
3. Pengaruh Perubahan Tekanan atau Volume Terhadap Kesetimbangan
Pada proses Haber Reaksi terjadi dalam ruang tertutup dan semua spesi adalah gas. Sehingga perubahan tekanan dan volume hanya berpengaruh pada sistem kesetimbangan antara fase gas dengan gas. Sedang sistem kesetimbangan yang melibatkan fasa cair atau padat, perubahan tekanan dan volume dianggap tidak ada.
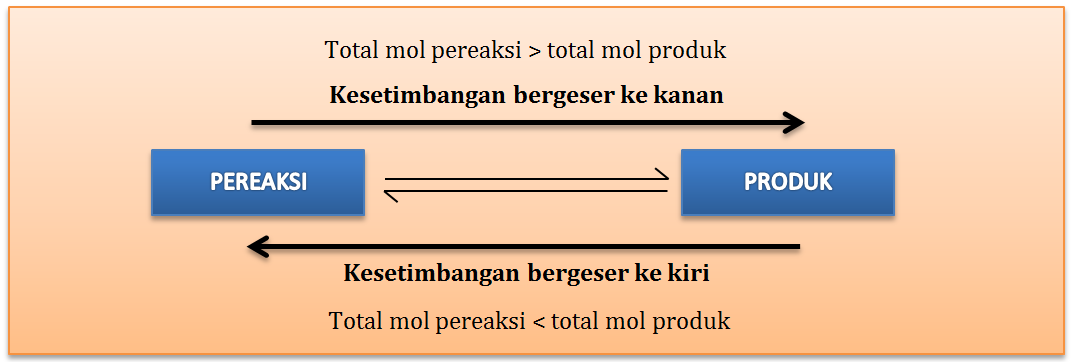
Menurut hukum gas ideal, bahwa tekanan berbanding lurus dengan jumlah mol gas dan berbanding terbalik dengan volume. Jika tekanan diperbesar maka jumlah mol juga bertambah, dan volume akan mengecil maka kesetimbangan akan bergeser ke arah reaksi yang jumlah molnya lebih kecil, dan volume akan besar maka kesetimbangan akan bergeser ke reaksi yang jumlah molnya lebih besar. Perhatikan reaksi berikut
N2(g) + 3H2(g) ⇄ 2NH3(g) H-92kJ
- Jika tekanan diperbesar (volume mengecil), maka kesetimbangan akan bergeser ke arah kanan, sebab jumlah molnya lebih kecil yaitu 2 mol.
- Jika tekanan dikurangi (volume bertambah), maka kesetimbangan akan bergeser ke kiri, Karena jumlah molnya lebih besar yaitu 4 mol.
Dengan demikian, dengan kita meningkatkan tekanan akan (mengurangi volume ruangan) pada campuran yang setimbang menyebabkan reaksinya bergeser ke sisi yang mengandung jumlah molekul gas yang paling sedikit.
Sebaliknya, menurunkan tekanan (memperbesar volume ruangan) pada campuran yang setimbang menyebabkan reaksinya bergeser ke sisi yang mengandung jumlah molekul gas yang paling banyak. Sementara untuk reaksi yang tidak mengalami perubahan jumlah molekul gas (mol reaktan = mol produk), faktor tekanan dan volume tidak mempengaruhi kesetimbangan kimia.
4. Pengaruh Katalis Terhadap Kesetimbangan
Katalisator dalam reaksi bolak-balik dapat mempercepat reaksi ke kanan atau ke kiri sehingga keadaan kesetimbangan tercapai.

