Soal No. 1
Apa yang dimaksud dengan struktur Lewis?
Pembahasan:
Struktur lewis adalah penggambaran elektron valensi suatu atom dengan notasi (penulisan lambang atom dikelilingi oleh titik di sekitarnya).
Soal No. 2
Gambarkan konfigurasi elektron dan struktur Lewis unsur-unsur di bawah ini!
- 11Na
- 6C
- 8O
- 17Cl
- 12Mg
Pembahasan:
1. Konfigurasi elektron 11Na = 2, 8, 1
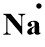
2. Konfigurasi elektron 6C = 2, 4
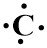
3. Konfigurasi elektron 8O = 2, 6
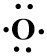
4. Konfigurasi elektron 17Cl = 2, 8, 7
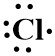
5. Konfigurasi elektron 12Mg = 2, 8, 2
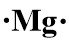
Soal No. 3
Tuliskan struktur Lewis senyawa ion berikut ini: (Ca = 20; O = 8; K = 19; Br = 35; Ba = 56; Cl =17)
- CaO
- Kalium bromida
- BaCl2
Pembahasan:
Untuk dapat menuliskan struktur Lewis suatu senyawa kita perlu menuliskan konfigurasi elektron tiap unsur dan mencari elektron valensinya, serta jumlah pasangan elektron ikatnya.
1. CaO (Kalsium Oksida)
Konfigurasi elektron:
20Ca = 2, 8, 8, 2
8O = 2, 6
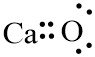
2. KBr (Kalium bromida)
Konfigurasi elektron:
19K = 2, 8, 8, 1
35Br = 2, 8, 18, 7
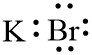
3. BaCl2 (Barium klorida)
Konfigurasi elektron:
56Ba = 2, 8, 18, 18, 8, 2
17Cl = 2, 8, 7
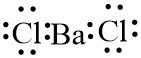
Soal No. 4
Tuliskan struktur Lewis senyawa kovalen berikut ini: (C = 4; H = 1; O = 8; F = 9)
- CH3OH
- CH2O
- COF2
Pembahasan:
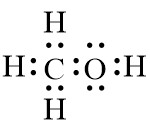
1. Sturktur Lewis CH3OH
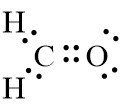
2. Sturktur Lewis CH2O
3. Sturktur Lewis COF2

Soal No. 5
Salin tabel berikut dan lengkapilah.
| Lambang Unsur | Konfigurasi Elektron | Elektron Valensi | Struktur Lewis | Pasangan Elektron | Elektron Ikatan |
| 42He | …. | …. | …. | …. | …. |
| 3115P | …. | ….. | …. | …. | …. |
| 3216S | …. | …. | …. | …. | …. |
| 35,517Cl | …. | …. | …. | …. | …. |
Pembahasan:
| Lambang Unsur | Konfigurasi Elektron | Elektron Valensi | Struktur Lewis | Pasangan Elektron | Elektron Ikatan |
| 42He | 2 | 2 | 1 | 0 | |
| 3115P | 2 8 5 | 5 | 1 | 3 | |
| 3216S | 2 8 6 | 6 | 2 | 2 | |
| 35,517Cl | 2 8 7 | 7 | 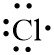 |
3 | 1 |
Soal No. 6
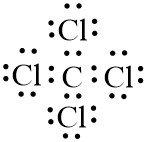
Buatlah struktur Lewis molekul HF dan CCl4
Pembahasan:
Struktur Lewis Molekul HF
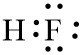
Struktur Lewis Molekul CCl4
Soal No. 7
Hidrogen bereaksi dengan klor membentuk hidrogen klorida, HCl.
- Tuliskan struktur Lewis molekul HCl!
- Ikatan apa yang terdapat pada HCl?
- Sebutkan sifat HCl akibat ikatannya!
Pembahasan:
1. Struktur Lewis HCl

2. Ikatan yang terdapat pada HCl adalah ikatan kovalen, karena terbentuk berdasarkan penggunaan bersama pasangan elektron.
3. Sifat HCl akibat ikatannya yaitu: mempunyai titik didih dan titik leleh rendah, mudah larut dalam pelarut non-polar, pada suhu kamar berbentuk lunak, dapat menghantarkan arus listrik.
Soal No. 8
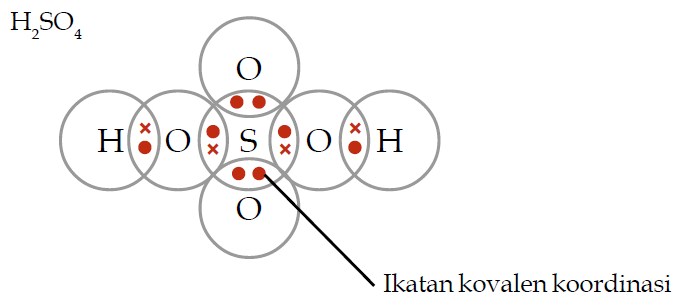
Gambarkan struktur Lewis dari H2SO4 berdasarkan susunan elektron valensinya sehingga dapat membentuk jenis ikatan tertentu yang mengikuti aturan oktet/duplet.
Pembahasan: