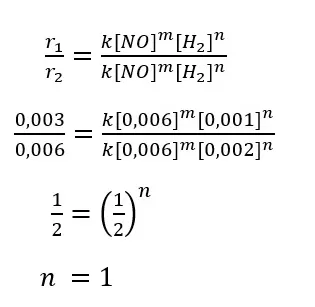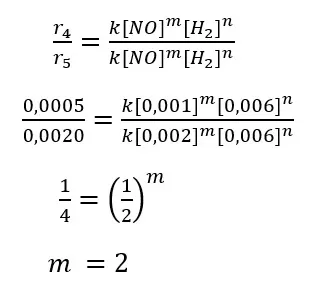Untuk mencari orde reaksi dari tabel perhatikan penjelasan berikut.
Tabel berikut ini menunjukkan hasil percobaan penentuan laju reaksi berdasarkan konsentrasi awal antara gas hidrogen dengan nitrogen monoksida yang dilakukan pada suhu 800°C, dengan persamaan reaksi berikut.
2H2(g) + 2NO(g) → 2H2O(g) + N2(g)
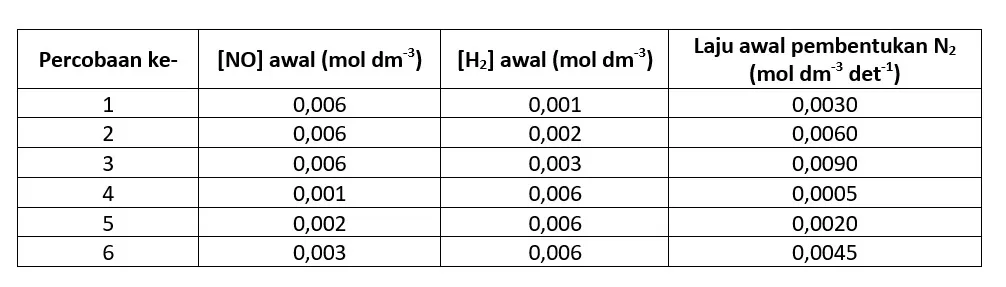
Percobaan 1, 2, dan 3 menunjukkan konsentrasi NO dibuat tetap (sebagai variabel kontrol) untuk mengetahui pengaruh konsentrasi gas H2 terhadap laju reaksi (sebagai variabel manipulasi). Sebaliknya, pada percobaan 4, 5, dan 6 yang menjadi variabel kontrolnya adalah konsentrasi gas H2 dan sebagai variabel manipulasinya adalah konsentrasi gas NO.
Dari percobaan 1 dan 2 didapat, jika konsentrasi gas H2 diduakalikan pada saat konsentrasi awal gas NO tetap, laju reaksinya menjadi dua kali lebih cepat. Jika konsentrasi gas H2 ditigakalikan (percobaan 1 dan 3), laju reaksinya menjadi tiga kali dari laju semula.
Secara matematis, untuk mencari orde reaksi H2 dari tabel hasil percobaan tersebut dapat kita lakukan dengan langkah-langkah sebagai berikut.
Sementara itu, dari percobaan 4 dan 5 terlihat bahwa jika konsentrasi NO diduakalikan pada saat konsentrasi awwal gas H2 tetap, laju reaksi menjadi 4 kali lebih cepat. Jika konsentrasi NO ditigakalikan (percobaan 4 dan 6), laju reaksinya menjadi 9 kali lebih cepat.
Secara matematis, untuk mencari orde reaksi NO dari tabel hasil percobaan tersebut dapat kita lakukan dengan langkah-langkah sebagai berikut.
Tingkat reaksi total atau orde reaksi total adalah jumlah total dari orde reaksi semua pereaksi. Sehingga didapatkan:
Orde reaksi total = n + m = 1 + 2 = 3.