Teori tumbukan adalah teori yang menjelaskan proses terjadinya reaksi. Teori tumbukan berbunyi “reaksi kimia terjadi karena adanya partikel-partikel yang saling bertumbukan”. Akan tetapi, tidak semua partikel-partikel yang bertumbukan akan menghasilkan reaksi kimia. Tumbukan yang dapat menghasilkan reaksi kimia dikenal dengan istilah tumbukan efektif.
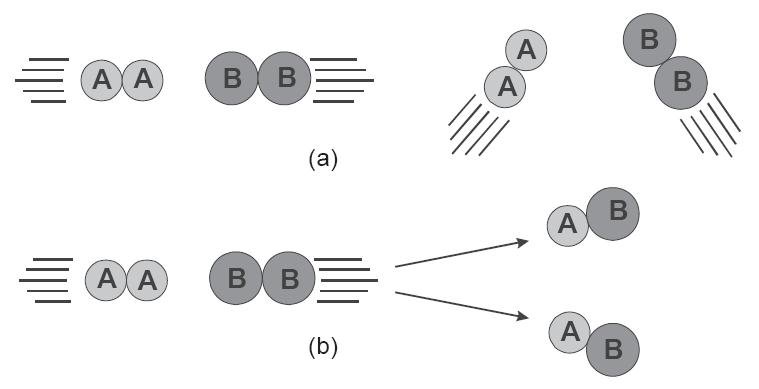

Bagaimana caranya agar terjadi tumbukan yang efektif?
Tumbukan yang efektif akan terjadi jika arah atau posisi antarmolekul yang bertumbukan berada pada posisi yang tepat. Selain posisi yang tepat, agar dapat terjadi reaksi kimia, maka energi tumbukan harus melewati energi penghalang yang dikenal dengan energi aktivasi. Energi aktivasi (Ea) adalah energi minimal agar terjadi suatu reaksi.
Arrhenius telah menemukan hungan antara energi aktivasi dengan tetapan laju reaksi. Persamaan Arrhenius tersebut secara matematika dapat dituliskan sebagai berikut.
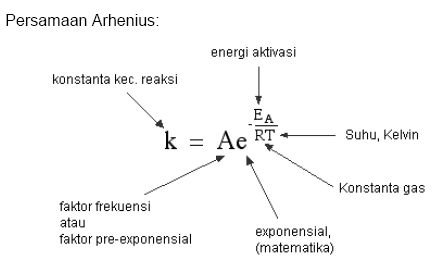
Keterangan
k = tetapan laju reaksi
A = tetapan Arrhenius
Ea = energi aktivasi (J/mol)
R = tetapan gas (8,3145 J/molK
T = suhu (K)
Dari persamaan tersebut faktor pra eksponen yaitu A merupakan faktor frekuensi. Karena hubungan antara tetapan kecepatan reaksi dengan faktor frekuensi tumbukan berbanding lurus, maka frekuensi tumbukan sangat mempengaruhi laju reaksi. Jika frekuensi tumbukan semakin tinggi, maka reaksi akan berjalan semakin cepat.
Untuk mengetahui teori tumbukan menjelaskan faktor-faktor yang mempengaruhi laju reaksi, perhatikan tabel berikut.
| Fakta | Teori |
| Peningkatan konsentrasi pereaksi dapat mempercepat laju reaksi | Peningkatan konsentrasi berarti jumlah partikel akan bertambah pada volume tersebut dan menyebabkan tumbukan antarpartikel lebih sering terjadi. Banyaknya tumbukan memungkinkan tumbuhan yang berhasil akan bertambah sehingga laju reaksi meningkat. |
| Peningkatan suhu dapat mempercepat laju reaksi | Suhu suatu system adalah ukuran dari rata-rata energi kinetik dari partikel-partikel pada sistem tersebut. Jika suhu naik maka energi kinetic partikel-partikel akan bertambah, sehingga kemungkinan terjadi tumbukan yang berhasil akan bertambah dan laju reaksi meningkat. |
| Penambahan luas permukaan bidang sentuh akan mempercepat laju reaksi | Makin besar luas permukaan, menyebabkan tumbukan makin banyak, karena makin banyak bagian permukaan yang bersentuhan sehingga laju reaksi makin cepat |
| Katalis dapat mempercepat reaksi | Katalis dapat menurunkan energi aktivasi (Ea), sehingga dengan energi yang sama jumlah tumbukan yang berhasil lebih banyak sehingga laju reaksi makin cepat |