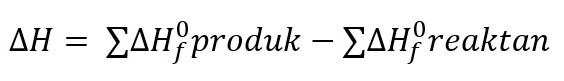Perubahan entalpi pembentukan standar adalah perubahan entalpi yang berupa energi diterima atau energi yang dilepas untuk melakukan pembentukan 1 mol zat dari unsur-unsurnya yang paling stabil pada keadaan standar. Perubahan entalpi pembentukan standar secara matematis dirumuskan sebagai berikut:
Satuan entalpi pembentukan standar adalah kilojoule per mol (kJ/mol). Nilai entalpi pembentukan standar ditentukan berdasarkan data entalpi pembentukan standar.
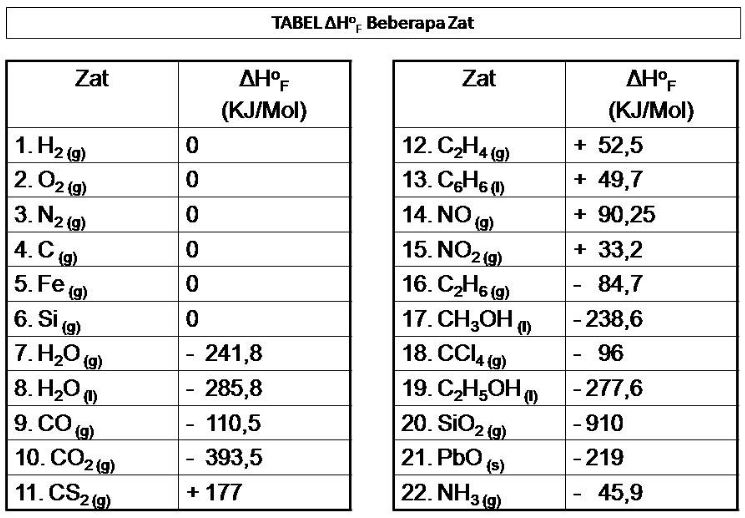
Nilai entalpi pembentukan standar dapat berupa negatif, nol, maupun positif. Nilai entalpi tersebut menentukan bagaimana energi itu dilepas atau diterima.
- Jika menerima energi maka entalpi pembentukan standar bernilai positif.
- Jika melepas energi maka entalpi pembentukan standar bernilai negatif.
- Jika unsur yang ada dalam reaksi sudah terdapat di alam secara alami maka entalpi pembentukan standar bernilai no.
Unsur-unsur yang mempunyai ∆H0f sama dengan 0 yaitu:
| Monoatomik | Poliatomik |
| Na(s) | H2(g) |
| K(s) | N2(g) |
| Mg(s) | O2(g) |
| Ca(s) | F2(g) |
| C(s) | Cl2(g) |
| S(s) | Br2(l) |
| Al(s) | I2(s) |
| Fe(s) | S8(s) |
| Zn(s) | P4(s) |