Teori Atom Dalton (1808) menandai awal era modern dalam bidang kimia. Hipotesis tentang sifat materi yang merupakan landasan teori atom Dalton dapat dirangkumkan sebagai berikut (Chang, 2004: 30):
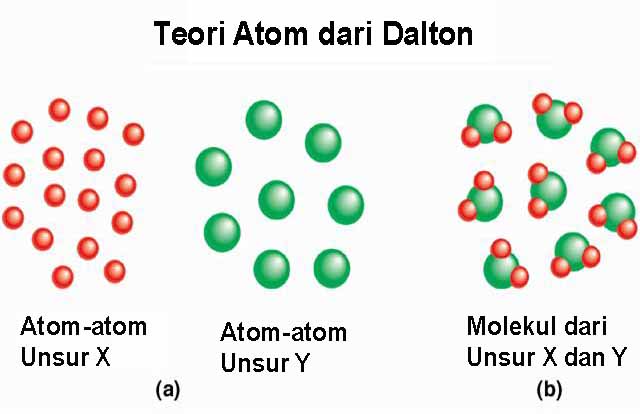
- Unsur tersusun atas partikel yang sangat kecil, yang disebut atom. Semua atom unsur tertentu adalah identik, yaitu mempunyai ukuran, massa dan sifat kimia yang sama. Atom suatu unsur tertentu berbeda dari atom unsur yang lain.
- Senyawa tersusun atas atom-atom dari dua unsur atau lebih.
- Pada reaksi kimia, yang terjadi hanyalah pemisahan, penggabungan, atau penyusunan ulang atom-atom.
Dalton membayangkan suatu atom yang sangat kecil dan tidak dapat dibagi. Tetapi serangkaian penyelidikan menunjukkan bahwa atom sesungguhnya memiliki struktur internal, yaitu atom tersusun atas partikel-partikel yang lebih kecil lagi, yang disebut partikel subatom. Penyelidikan tersebut mengarah pada penemuan tiga partikel subatom, yaitu elektron, proton, dan neutron (Sentot, 2012: 14).
Jumlah proton dalam inti atom suatu unsur sama dengan nomor atom unsur tersebut. Nomor atom menunjukkan identitas suatu unsur. Misalnya, suatu atom mempunyai 26 proton (mempunyai nomor atom Z= 26) adalah unsur besi (Fe), sedangkan atom dengan 50 proton (Z= 50) adalah atom timah (Sn). Pada atom netral, jumlah elektron juga sama dengan nomor atom. Total massa sebuah atom mendekati jumlah proton dan nautron pada intinya. Total massa ini disebut nomor massa (A), jumlah neutron dalam sebuah atom di dapat dari jumlah nomor massa dikurangi nomor atom (A-Z) (Petrucci & Suminar, 1999: 45; Suchoki, 2007: 92).
Cara yang lazim digunakan untuk menandai nomor atom dan nomor massa dari unsur X adalah sebagai berikut:
Tiap unsur kimia mempunyai nama dan lambang. Lambang umumnya merupakan bentuk singkatan sederhana dari nama Latinnya yang terdiri dari satu atau dua huruf, contohnya oksigen (O), tembaga (Cu/ cuprum), dan nitrogen (N).
