Berikut kami sajikan 20 Contoh Soal dan Pembahasan Reaksi Redoks dan Elektrokimia:
Soal No. 1
Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana asam)
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l)
Jawaban:
Tahap 1, kita tentukan reaksi ionnya
Cu(s) + NO3–(aq) → Cu2+(aq) + NO(g)
Tahap 2, kita setarakan muatannya, dengan menambah elektron di sebelah kanan untuk oksidasi dan sebelah kiri untuk reduksi
Cu(s) → Cu2+(aq) + 2e– (oksidasi)
NO3(aq) + 3e– → NO(g) (reduksi)
Tahap 3, kita setarakan H dan O
Cu(s) → Cu2+ (aq) + 2e–
NO3(aq) + 4H+(aq) + 3e– → NO(g) + 2H2O(l)
Tahap 4, kita susun reaksi sempurnanya
Soal No. 2
Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana basa)
NaCrO2(aq) + Br2(g) + NaOH(aq) → Na2CrO4(aq) + NaBr(s) + H2O(l)
Jawaban:
Tahap 1, kita tentukan reaksi ionnya
CrO2–(aq) + Br2(g) → CrO42-(aq) + Br–(g)
Tahap 2, kita setarakan muatannya
CrO2–(aq) → CrO42-(aq) + 3e– (Oksidasi)
Br2(g) + 2e– → 2Br–(g) (Reduksi)
Tahap 3, kita setarakan H dan O
CrO2–(aq) + 4OH–(aq) → CrO42-(aq) + 2H2O(l) + 3e– (Oksidasi)
Br2(g) + 2e– → 2Br–(g) (Reduksi)
Tahap 4, kita susun reaksi sempurnanya
CrO2–(aq) + 4OH–(aq) → CrO42-(aq) + 2H2O(l) + 3e– |x2|
Br2(g) + 2e– → 2Br–(g) |x3|
_______________________________________________+
2CrO22-(aq) + 3Br2(g) + 8OH–(l) → 2CrO42-(aq) + 6Br–(g) + 4H2O(aq)
Soal No. 3
Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana asam)
CuS + NO3– → Cu2+ + S + NO
Jawaban:
Oksidasi: S2- → S + 2e– |x 3|
Reduksi: NO3– + 4H+ + 3e– → NO + 2H2O |x 2|
______________________________________________+
3S2- + 2NO3– + 8H+ → 3S + 2NO + 4H2O
Soal No. 4
Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana basa)
MnO4– + C2O42- →MnO2 + CO2
Jawaban:
Oksidasi: C2O42- → 2CO2 + 2e– | x 3|
Reduksi: MnO4– + 2H2O + 3e– → MnO2 + 4OH– | x 2|
____________________________________________+
3C2CO42- + 2MnO4– + 4H2O → 6CO2 + 2MnO2 + 8OH–
Soal No. 5
Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana asam)
MnO4– + H2S + H+ → Mn2+ + S + H2O
Jawaban:
Oksidasi: H2S → S + 2H+ + 2e– | x5 |
Reduksi: MnO4– + 8H+ + 5e– → Mn2+ + 4H2O | x2 |
____________________________________________+
5H2S + 2MnO4– + 6H+ → 5S + 2Mn+ + 8H2O
Soal No. 6
Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana basa)
CrO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3
Jawaban:
Oksidasi: Fe(OH)2 + OH– → Fe(OH)3 + e– | x6 |
Reduksi: 2CrO42- + 5H2O + 6e– → Cr2O3 + 10OH– | x1 |
___________________________________________+
6Fe(OH)2 + 2CrO42- + 5H2O → 6Fe(OH)3 + Cr2O3 + 4OH–
Soal No. 7
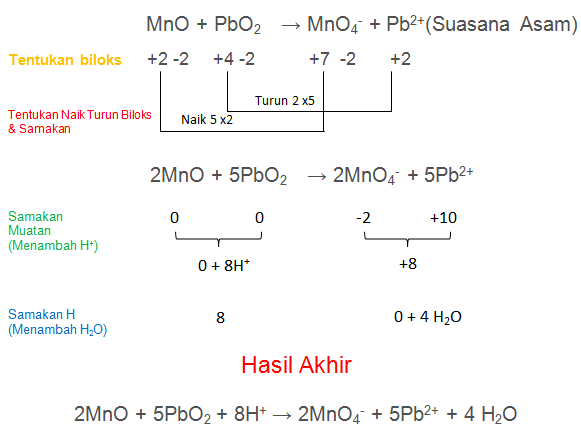
Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana asam)
MnO + PbO2 → MnO4– + Pb2+
Jawaban:
Soal No. 8
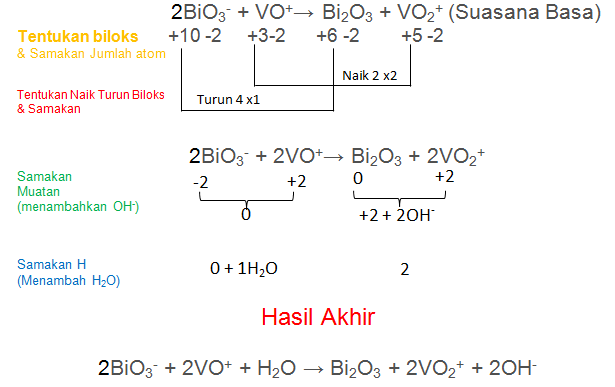
Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana basa)
2BiO3– + VO+ → Bi2O3 + VO2+
Jawaban:
Soal No. 9
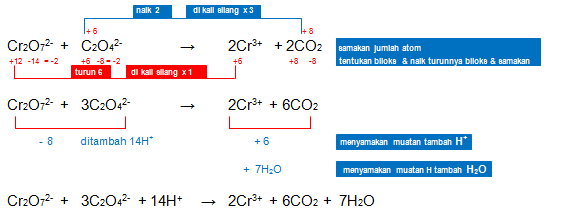
Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana asam)
Cr2O72-+ C2O42- → 2Cr3+ + 2CO2
Jawaban:
Soal No. 10
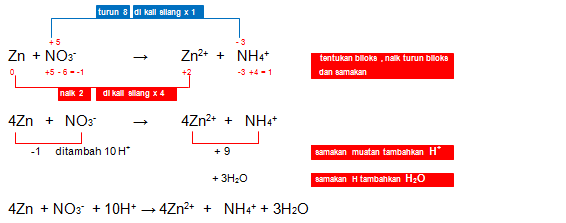
Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana asam)
Zn + NO3– → Zn2+ + NH4+
Jawaban: