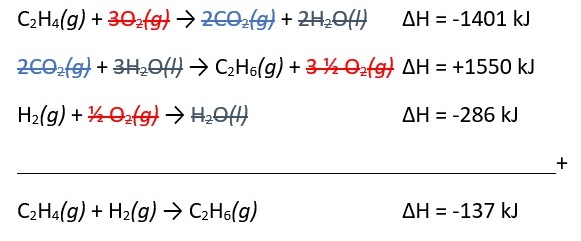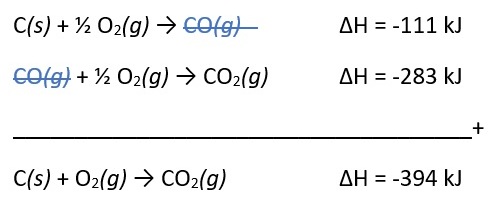Penerapan hukum hess dan energi ikatan memudahkan kita dalam menentukan perubahan entalpi reaksi yang sulit ditentukan secara percobaan. Perhatikan contoh soal hukum hess dan energi ikatan berikut ini.
Contoh Soal Hukum Hess
Soal No. 1
Diketahui:
H2O2(l) → H2O(l) + ½ O2(g) ∆H = -98,0 kJ
2H2(g) + O2(g) → 2H2O(l) ∆H = -571,6 kJ
Tentukan ∆H reaksi H2(g) + O2(g) → H2O2(l) dengan menggunakan kedua reaksi tersebut!
Penyelesaian:
Soal No. 2
Diketahui:
C(s) + O2(g) → CO2(g) ∆H = -393,5 kJ
H2(g) + ½ O2(g) → H2O(l) ∆H = -285,8 kJ
C2H6(g) + 3 ½ O2(g) → 2CO2(g) + 3H2O(g) ∆H = -1559,7 kJ
Tentukan ∆H reaksi 2C(s) + 3H2(g) → C2H6(g) !
Penyelesaian:
Soal No. 3
Hitung ∆H pembentukan etana dalam reaksi: C2H4(g) + H2(g) → C2H6(g) dengan menggunakan reaksi pembakaran berikut ini.
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(l) ∆H = -1401 kJ
C2H6(g) + 3 ½ O2(g) → 2CO2(g) + 3H2O(l) ∆H = -1550 kJ
H2(g) + ½ O2(g) → H2O(l) ∆H = -286 kJ
Penyelesaian:
Soal No. 4
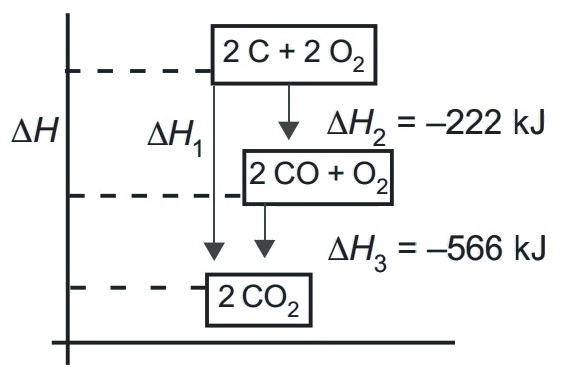
Diketahui diagram tingkat energi
Tentukan entalpi standar pembentukan gas CO2!
Penyelesaian:
Berdasarkan Hukum Hess
∆H1 = ∆H2 + ∆H3
∆H1 = -222 + (-566)
∆H1 = -788 kJ
∆H0f CO2 = -788/2 = -394 kJ/mol
Soal No. 5
Diketahui persamaan termokimia
C(s) + ½ O2(g) → CO(g) ∆H = -111 kJ
CO(g) + ½ O2(g) → CO2(g) ∆H = -283 kJ
Tentukan perubahan entalpi standar pembentukan gas CO2!
Penyelesaian:
Contoh Soal Energi Ikatan
Soal No. 1
Diketahui harga energi ikatan rata-rata:
C – C : 415 kJ
Cl – Cl : 242,6 kJ
C – Cl : 328 kJ
H – Cl : 341 kJ
Tentukan ∆Hreaksi CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)!
Penyelesaian:
Soal No. 2
Diketahui:
∆H0f C(g) = 716,7 kJ/mol
∆H0f H(g) = 218 kJ/mol
∆H0f C2H6(g) = -84,7 kJ/mol
Energi ikatan C – H = 415,8 kJ/mol
Tentukan besarnya energi ikatan C – C pada C2H6!
Penyelesaian:
Soal No. 3
Pada reaksi pembakaran etanol dihasilkan gas karbon dioksida dan air. Berdasarkan data energi ikatan, tentukan kalor pembakaran etanol.
C2H5OH(aq) + 3O2(g) → 2CO2(g) + 3H2O(l)
Penyelesaian:
Soal No. 4
Diketahui data energi ikat beberapa ikatan sebagai berikut
- C≡C: +839 kJ.mol-1
- C-C: +348 kJ.mol-1
- C-H: +413 kJ.mol-1
- H-H: +436 kJ.mol-1
Nilai ∆H untuk reaksi tersebut adalah …
Penyelesaian:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (C≡C + C – C + (4 x C – H) + (2 x H – H)) – ((2 x C – C) + (8 x C – H))
∆Hreaksi = (C≡C + (2 x H – H)) – (C – C + (4 x C – H))
∆Hreaksi = (839 + (2 x 436)) – (348+ (4 x 413))
∆Hreaksi = 1711 – 2000 = -289 kJ/mol
Soal No. 5
Bila diketahui energi ikatan rata-rata N – H pada NH3 = 391 kJ/mol, H – H = 435 kJ/mol, energi ikatan rata-rata rangkap tiga N = 946 kJ/mol, maka entalpi pembentukan gas NH3 adalah ….
Penyelesaian:
Persamaan reaksi pembentukan NH3:
½ N2 + 3/2 H2 → NH3
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (½ x N≡N) + (3/2 x H – H) – (3 x N – H)
∆Hreaksi = (½ x 946 ) + (3/2 x 435) – ( 3 x 391)
∆Hreaksi = 473 + 652,5 – 1173 = –47,5 kJ/mol