Perubahan entalpi standar merupakan selisih entalpi akhir dengan entalpi awal yang diukur pada suhu 298 K dan tekanan 1 atm. Dalam reaksi kimia, entalpi akhir adalah entalpi produk dan entalpi awal adalah entalpi reaktan. Perubahan entalpi standar dirumuskan sebagai berikut.
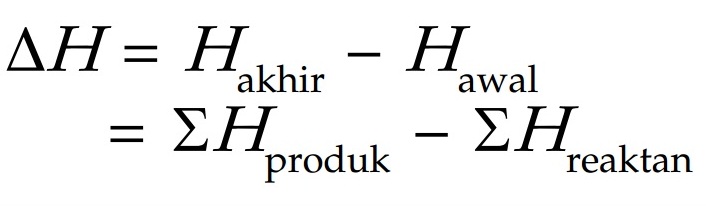
Ada macam-macam perubahan entalpi standar yang meliputi:
1. Perubahan Entalpi Pembentukan Standar (∆Hf)
Perubahan entalpi pembentukan standar adalah perubahan entalpi ketika terbentuk 1 mol senyawa pada keadaan standar. Contohnya pada persamaan termokimia pembentukan H2O beriku ini.
H2(g) + ½ O2(g) → H2O(l) ∆H = -285,9 kJ
Dari persamaan diatas dapat kita lihat bahwa pembentukan 1 mol H2O dari H2 dan O2 diperlukan energi sebesar -285,9 kJ
2. Perubahan Entalpi Pembakaran Standar (∆Hc)
Perubahan entalpi pembakaran standar adalah perubahan entalpi ketika 1 mol zat terbakar sepurna pada keadaan standar. Contoh persamaan termokimia untuk reaksi pembakaran:
C2H6(g) + 3 ½ O2(g) → 2CO2(g) + 3H2O(g) ∆H = -2803 kJ
3. Perubahan Entalpi Pengatoman Unsur Standar (∆Hat)
Perubahan entalpi pengatoman unsur standar adalah perubahan entalpi ketika 1 mol atom dalam bentuk gas terbentuk dari unsur dalam bentuk fisik pada kondisi standar. Contoh persamaan termokimia untuk reaksi pengatoman.
½ H2(g) → H(g) ∆H = +218 kJ
4. Perubahan Entalpi Pengatoman Senyawa Standar (∆Hat)
Perubahan entalpi pengatoman senyawa standar adalah perubahan entalpi ketika 1 mol atom dalam bentuk gas terbentuk dari senyawa dalam bentuk fisik pada kondisi standar. Contoh persamaan termokimia untuk reaksi pengatoman senyawa.
CH4(g) → C(g) + 4H(g) ∆H = +1662 kJ
5. Perubahan Entalpi Pelarutan Standar (∆Hl)
Perubahan entalpi pelarutan standar adalah perubahan entalpi ketika 1 mol zat diubah menjadi larutan dalam keadaan standar. Contoh persamaan termokimia untuk reaksi pelarutan.
NaOH(s) → NaOH(aq) ∆H = +50kJ
6. Perubahan Entalpi Peleburan Standar (∆Hfus)
Perubahan entalpi peleburan standar adalah perubahan entalpi ketika 1 mol zat padat diubah menjadi zat cair pada titik leburnya dan tekanan standar. Contoh persamaan termokimia untuk reaksi peleburan.
H2O(s) → H2O(l) ∆H = +6,01kJ
7. Perubahan Entalpi Penguapan Standar (∆Hvap)
Perubahan entalpi penguapan standar adalah perubahan entalpi ketika 1 mol zat cair diubah menjadi zat gas pada titik didihnya dan tekanan standar. Contoh persamaan termokimia untuk reaksi penguapan.
H2O(l) → H2O(g) ∆H = +44,05kJ