Dalam menghitung nilai sifat koligatif larutan elektrolit kita dapat menggunakan persamaan-persamaan dalam larutan nonelektrolit dengan menambahkan faktor Van’t Hoff. Nilai faktor Van’t Hoff merupakan perbandingan antara efek koligatif larutan elektrolit dengan efek koligatif larutan nonelektrolit pada konsentrasi yang sama.
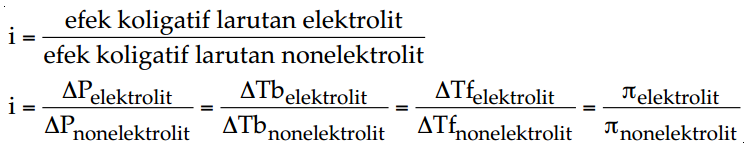
Selain itu, faktor Van’t Hoff juga dapat ditentukan dengan menggunakan derajat ionisasi (α). Dalam kasus ini, faktor Van’t Hoff dirumuskan sebagai berikut:
i = 1 + (n-1)α
Keterangan:
i = faktor Van’t Hoff
n =jumlah ion
α = derajat ionisasi
Selanjutnya, sifat koligatif larutan elektrolit dinyatakan sebagai berikut:
1. Penurunan Tekanan Uap Jenuh (∆P)
∆P = P0 . Xt . i
Keterangan:
∆P = tekanan uap jenuh (mmHg)
P0 = tekanan uap pelarut murni (mmHg)
Xt = fraksi mol zat terlarut
i = faktor Van’t Hoff
2. Kenaikan Titik Didih (∆Tb)
∆Tb = Kb . m . i
Keterangan:
∆Tb = kenaikan titik didih (0C)
Kb = tetapan kenaikan titik didih (0C/m)
m = molalitas larutan (m)
i = faktor Van’t Hoff
3. Penurunan Titik Beku (∆Tf)
∆Tf = Kf . m . i
Keterangan:
∆Tf = penurunan titik beku (0C)
Kf = tetapan penurunan titik beku (0C/m)
m = molalitas larutan (m)
i = faktor Van’t Hoff
4. Tekanan Osmosis Larutan (∏)
∏ = M . R . T . i
Keterangan:
∏ = tekanan osmosis larutan (atm)
M = molaritas (M)
R = tetapan gas (0,082 L.atm.mol-1.K-1)
T = suhu mutlak (K)
i = faktor Van’t Hoff