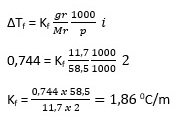Soal UNBK Kimia 2018 dan Pembahasannya No. 21-25
Soal UN Kimia No. 21
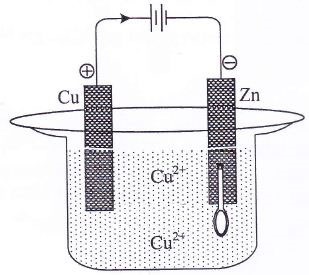
Sendok logam yang terbuat dari zink akan disepuh dengan logam tembaga.
Reaksi yang terjadi di katoda adalah ….
A. Cu2+(aq) + Zn(s) → Cu(s) + Zn2+
B. Zn(s) → Zn2+(aq) + 2e
C. Zn2+(aq) + 2e → Zn(s)
D. Cu(s) → Cu2+(aq) + 2e
E. Cu2+(aq) + 2e → Cu(s)
Jawaban: E
Pembahasan:
Reaksi:
- Anoda : Cu(s) → Cu2+(aq) + 2e
- Katoda : Cu2+(aq) + 2e → Cu(s)
Soal UN Kimia No. 22
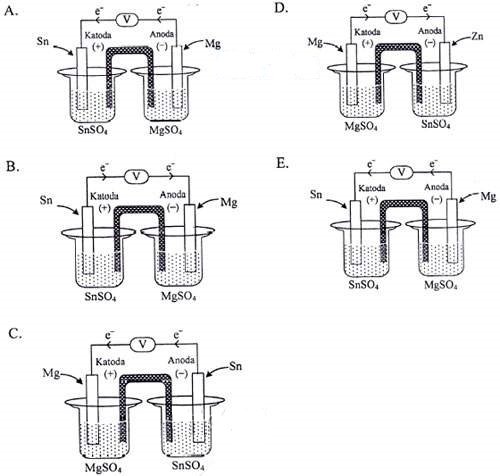
Diketahui notasi sel volta: Mg|Mg2+||Sn2+|Sn, E = 2,23 volt.
Gambar sel volta berdasarkan notasi sel tersebut adalah ….
Jawaban: A dan E
Pembahasan:
- anoda : Mg
- katoda : Sn
- arah elektron : dari anoda ke katoda
Jadi, gambar sel volta berdasarkan notasi sel tersebut adalah gambar A dan gambar E.
Soal UN Kimia No. 23
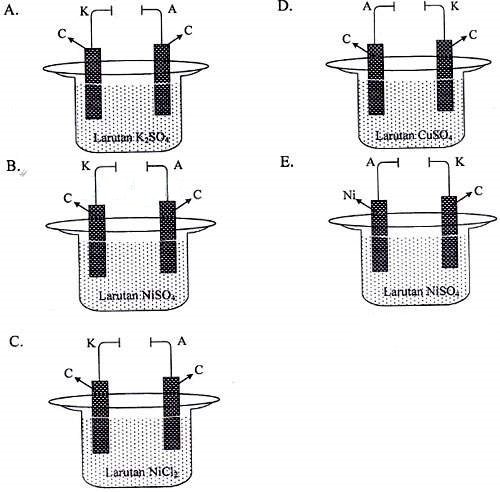
Elektrolisis suatu larutan menghasilkan reaksi seperti berikut.
Katoda (−) : Ni2+(aq) + 2e → Ni(s)
Anoda (+) : 2H2O(l) → O2(g) + 4H+(aq) + 4e
⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯
Reaksi sel : Ni2+(aq) + 2H2O(l) → O2(g) + 4H+(aq) + Ni(s)
Gambar yang tepat untuk peristiwa elektrolisis tersebut adalah ….
Jawaban: B
Pembahasan:
Karena di anoda terjadi oksidasi air, itu artinya terdapat unsur O di anion dan menggunakan elektroda yang bukan merupakan elektroda aktif.
Soal UN Kimia No. 24
Pada percobaan pengujian titik beku larutan urea yang massanya sama dengan massa larutan NaCl (11,7 g dalam 1 L larutan) ternyata menghasilkan titik beku yang berbeda. Tf larutan urea = −0,367 ℃ dan Tf larutan NaCl = −0,744 ℃. Jika MrCO(NH2)2 = 60 dan Mr NaCl = 58,5 serta derajat ionisasi = 1, besarnya tetapan penurunan titik beku molal dari kedua percobaan adalah ….
A. 0,031 ℃/m
B. 0,520 ℃/m
C. 0,604 ℃/m
D. 1,86 ℃/m
E. 3,72 ℃/m
Jawaban: D
Pembahasan:
Diketahui:
Mr CO(NH2)2 = 60
gr CO(NH2)2 = 11,7 gr
p CO(NH2)2 = 1 L = 1000 gr
∆Tf CO(NH2)2 = 0 – ( – 0,367) = 0,3670C
Mr NaCl = 58,5
gr NaCl = 11,7 gr
p NaCl = 1 L = 1000 gr
∆Tf NaCl = 0 – (- 0,744) = 0,7440C
α = 1
i = 2
Ditanyakan: Kf = …?
Jawaban:
Tetapan penurunan titik beku molal CO(NH2)2
Tetapan penurunan titik beku molal NaCl
Jadi, tetapan penurunan titik beku molal dari kedua percobaan adalah 1,88 0C/m dan 1,86 0C/m.
Soal UN Kimia No. 25
Data percobaan tentang titik beku larutan pada suhu 27 ℃ dan tekanan 1 atm tercantum pada tabel berikut.
| No | Zat terlarut | Larutan | |
| Konsentrasi (m) | Titik beku (℃) | ||
| (1) | CO(NH2)2 | 1 | −2 |
| (2) | CO(NH2)2 | 2 | −4 |
| (3) | NaCl | 1 | −4 |
| (4) | NaCl | 2 | −8 |
Pada konsentrasi yang sama, larutan CO(NH2)2 dan NaCl memiliki titik beku yang berbeda. Hal ini disebabkan kedua larutan ….
A. mempunyai molekul yang tidak sama besarnya
B. mempunyai derajat ionisasi yang sama
C. menghasilkan jumlah partikel yang tidak sama banyak
D. sama-sama larutan elektrolit
E. sama-sama larutan nonelektrolit
Jawaban: C