Soal UNBK Kimia 2018 dan Pembahasannya No. 26-30
Soal UN Kimia No. 26
Diketahui energi rata-rata:
H – H : 435 kJ/mol
N ≡ N : 946 kJ/mol
N – H : 390 kJ.mol
Kalor yang diperlukan untuk menguraikan 1,7 gram gas amoniak (Ar N = 14 g/mol; H = 1 g/mol) menjadi unsur-unsurnya adalah ….
A. 4,45 kJ
B. 8,9 kJ
C. 108,1 kJ
D. 1081 kJ
E. 1170 kJ
Jawaban: A
Pembahasan:
Diketahui:
H – H : 435 kJ/mol
N ≡ N : 946 kJ/mol
N – H : 390 kJ.mol
gr = 1,7 gr
Ar N = 14 g/mol; H = 1 g/mol
Jawaban:
n NH3 = gr/Mr = 1,7/17 = 0,1 mol
Reaksi:
NH3 → 1/2 N2 + 3/2 H2
Pertama kita cari energi untuk menguraikan 1 mol NH3
∆Hreaksi = energi ruas kiri − energi ruas kanan
∆Hreaksi = 3(N-H) – ½(N≡N) – 3/2(H-H)
∆Hreaksi = 3×390 − ½ × 946 − 3/2 × 435
∆Hreaksi = 1170 − 473 − 652,5
∆Hreaksi = 44,5 kJ
Untuk menguraikan 1 mol NH3 kita membutuhkan energi sebesar 44,5 kJ. Sehingga, untuk menguraikan 1,7 gram amoniak membutuhkan energi sebesar:
∆Hreaksi = n x 44,5 = 0,1 x 44,5 = 4,45 kJ
Soal UN Kimia No. 27
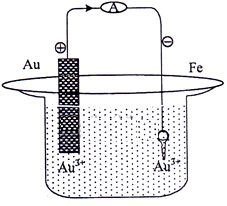
Kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9650 detik, seperti gambar berikut.
Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday, massa logam emas yang melapisi kunci besi tersebut adalah … (Ar Au = 197 g/mol).
A. 0,0985 gram
B. 0,2985 gram
C. 0,9850 gram
D. 2,9850 gram
E. 9,050 gram
Jawaban: C
Pembahasan:
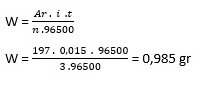
Diketahui:
n = 3
i∙t = 0,015 F
Ar = 197 g/mol
Ditanyakan: W = …?
Jawaban:
Soal UN Kimia No. 28
Perhatikan wacana berikut!
Senyawa aktif pada pemutih adalah senyawa natrium hipoklorit (NaClO). Untuk menghitung kada NaClO dalam pemutih digunakan reaksi iodometri, yaitu:
NaClO(l) + 2KI(aq) + 2HCl(aq) → NaCl(aq) + 2KCl (aq) + I2(l) + H2O(l)
I2(l) + 2Na2S2O3(aq) → 2NaI(aq) + Na2S2O6(aq)
Berdasarkan wacana tersebut, untuk menghitung kadar NaClO dalam pemutih digunakan titrasi iodometri dengan Na2S2O3 sebagai larutan standar. Jika 20 mL NaClO dititrasi memerlukan 15 mL Na2S2O3 0,1 M maka kadar NaClO dalam pemutih tersebut adalah …
(Mr NaClO = 74,5; ρ NaClO = 1 g/mL)
A. 0,279%
B. 0,558%
C. 1,116%
D. 2,232%
E. 4,464%
Jawaban: A
Pembahasan:
Pertama kita cari dulu mol Na2S2O3
mol Na2S2O3 = MV
mol Na2S2O3 = 0,1 × 15 mmol = 1,5 mmol
Setelah mol Na2S2O3 ketemu, kita gunakan untuk menghitung mol NaClO
mol NaClO = 1/2 × mol Na2S2O3
mol NaClO = 1/2 × 1,5 mmol = 0,75 mmol
Dari mol NaClO kita bisa mencari massa NaClO setelah titrasi
gr NaClO = mol × Mr
gr NaClO = 0,75 mmol × 74,5 g/mol
gr NaClO = 55,875 mg = 0,055875 g
Sementara itu, massa NaClO sebelum titrasi dapat kita cari dengan cara
gr NaClO = ρV
gr NaClO = 1 gr/mL × 20 mL = 20 gr
Karena massa NaClO sebelum dan sesudah titrasi telah ditentukan, maka kita bisa mencari kadar NaClO dengan cara:
%NaClO = 0,055875/20 × 100% = 0,279%
Jadi, kadar NaClO dalam pemutih tersebut adalah 0,279%.
Soal UN Kimia No. 29
Diketahui data entalpi pembentukan standar sebagai berikut:
∆Hf0 CO2(g) = −394 kJ/mol
∆Hf0 H2O (g) = −286 kJ/mol
∆Hf0 C2H5OH(g) = −266 kJ/mol
Entalpi pembakaran standar dari pembakaran etanol menurut reaksi:
C2H5OH(g) + 3O2(g) → 2CO2(g) + 3H2O(g)
adalah ….
A. −1094 kJ/mol
B. −1380 kJ/mol
C. −1488 kJ/mol
D. −2986 kJ/mol
E. −2020 kJ/mol
Jawaban: B
Pembahasan:
∆Hreaksi = ∆Hhasil – ∆Hpereaksi
∆Hreaksi = 2∆Hf CO2 +3∆Hf H2O − ∆Hf C2H5OH
∆Hreaksi = 2×(−394) + 3×(−286) − (−266)
∆Hreaksi = −788 − 858 + 266
∆Hreaksi = −1380 kJ/mol
Soal UN Kimia No. 30
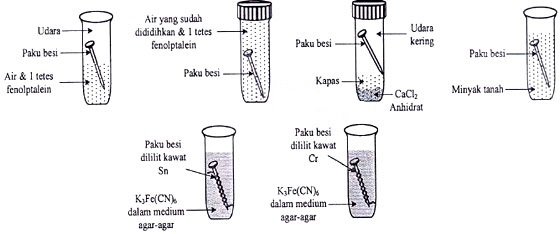
Seorang siswa melakukan percobaan menyelidiki faktor-faktor penyebab korosi pada besi. Bahan besi yang digunakan adalah paku yang telah diamplas. Diagram percobaan yang dilakukan adalah sebagai berikut:
Keterangan:
- Indikator fenolftalein membentuk warna merah muda jika terdapat ion OH−.
- CaCl2 anhidrat merupakan zat yang higroskopis (menyerap air) sehingga udara dalam tabung bebas uap air.
- Air yang sudah dididihkan kehilangan oksigen terlarut.
- K3Fe(CN)6 membentuk kompleks warna biru jika terdapat ion Fe2+.
Setelah 2 hari kemudian diperoleh data sebagai berikut
| Tabung | 1 | 2 | 3 | 4 | 5 | 6 |
| Pengamatan | Paku berkarat muncul warna merah muda | Paku tidak berkarat tidak terjadi perubahan warna | Paku tidak berkarat | Paku tidak berkarat | Terbentuk warna biru sepanjang batang paku | Tidak terbentuk warna biru |
Berdasarkan percobaan tersebut, faktor penyebab terjadinya korosi besi adalah ….
A. besi memiliki kemampuan mengalami reduksi > dari Zn
B. adanya ion OH− (suasana basa) di sekitar besi
C. E0 reduksi besi < E0 reduksi air
D. besi merupakan oksidator kuat
E. adanya gas oksigen dan uap air di sekitar besi
Jawaban: E