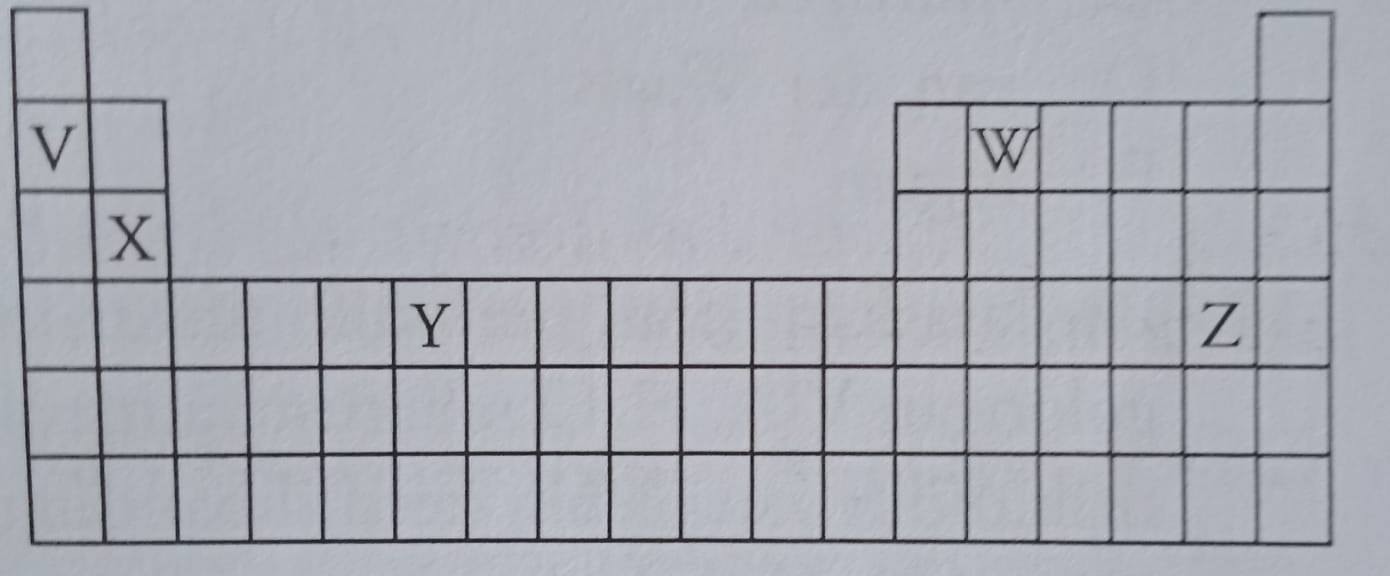A. Soal Pilihan Ganda
1. Perhatikan nomor atom dari masing-masing unsur berikut.
- 4P
- 11Q
- 16R
- 21S
- 34T
Pasangan unsur yang memiliki jumlah elektron valensi sama ditunjukkan oleh nomor ….
A. (1) dan (2)
B. (1) dan (5)
C. (2) dan (4)
D. (3) dan (4)
E. (3) dan (5)
Jawaban: E
2. Perhatikan tabel periodik unsur berikut.
Letak unsur yang sesuai dengan nomor atom dan konfigurasi elektronnya adalah ….
| Unsur | Nomor atom | Konfigurasi elektron | |
| A. | V | 2 | 1s2 2s2 |
| B. | W | 6 | 1s2 2s2 2p6 |
| C. | X | 12 | [Ne] 3s2 |
| D. | Y | 24 | [Ar] 3d4 4s2 |
| E. | Z | 35 | [Ar] 3d10 4s2 4p3 |
Jawaban: C
3. Atom mangan memiliki nomor atom 25. Jumlah elektron yang tidak berpasangan pada ion Mn2+ adalah …. Buah.
A. 6
B. 5
C. 4
D. 3
E. 2
Jawaban: D
4. Ion X– mempunyai konfigurasi elektron [Ar] 3d10 4s2 4p6. Nomor atom unsur X adalah ….
A. 33
B. 34
C. 35
D. 36
E. 37
Jawaban: A
5. Atom unsur Q dapat membentuk kation bermuatan +2 dan di dalam inti atom terdapat 12 proton. Jumlah elektron dalam ion tersebut adalah ….
A. 10
B. 11
C. 12
D. 13
E. 14
Jawaban: A
6. Unsur Y memiliki nomor atom 38. Unsur tersebut termasuk golongan ….
A. Alkali
B. Alkali tanah
C. Halogen
D. Gas mulia
E. Transisi
Jawaban: B
7. Nomor atom unsur P, Q, R, dan S secara berturut-turut adalah 9, 11, 18, dan 21. Pasangan unsur yang terletak pada periode yang sama adalah ….
A. P dan Q
B. P dan R
C. Q dan R
D. Q dan S
E. R dan S
Jawaban: C
8. Suatu unsur terletak pada golongan IIIA dan periode 4. Nomor atom unsur tersebut adalah ….
A. 30
B. 31
C. 32
D. 33
E. 34
Jawaban: B
9. Berdasarkan sifat periodik, pernyataan yang benar dalam satu golongan dari atas ke bawah adalah ….
A. Sifat logam berkurang
B. Keelektronegatifan bertambah besar
C. Afinitas elektron berkurang
D. Energi ionisasi bertambah besar
E. Jari-jari atom bertambah pendek.
Jawaban: C
10. Perhatikan data keelektronegatifan beberapa unsur berikut.
V = 1,2
W = 3,0
X = 4,0
Y = 2,5
Z = 3,5
Unsur yang paling mudah menarik elektron adalah ….
A. V
B. W
C. X
D. Y
E. Z
Jawaban: X
11. Unsur Be, Mg, Ca, Sr, dan Ba terletak dalam satu golongan. Unsur yang memiliki titik didih paling tinggi adalah …
A. Ba
B. Sr
C. Ca
D. Mg
E. Be
Jawaban: E
12. Unsur 11X berikatan dengan unsur 16Y membentuk senyawa. Rumus molekul yang terbentuk adalah ….
A. XY
B. XY2
C. X2Y
D. X3Y3
E. X4Y3
Jawaban: C
13. Atom X mempunyai konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s1. Senyawa yang mungkin dibentuk oleh atom tersebut adalah ….
A. XS2
B. XCl2
C. XBr
D. NaX
E. BaX
Jawaban: C
14. Unsur P dengan nomor atom 5 dan unsur Q dengan nomor atom 17 membentuk senyawa PQ3. Bentuk molekul senyawa tersebut adalah ….
A. Bengkok
B. Trigonal bipiramida
C. Segitiga piramida
D. Trigonal planar
E. Tetrahedral
Jawaban: D
15. Pasangan senyawa berikut yang termasuk senyawa kovalen non-polar adalah….
A. BCl3 dan H2O
B. H2O dan NH3
C. NaCl dan NH3
D. CH4 dan HCl
E. CH4 dan BCl3
Jawaban: E
16. Perhatikan sifat-sifat senyawa berikut.
- Mengkilap
- Dapat menghantarkan listrik dan panas
- Memiliki titik didih dan titik leleh yang tinggi
- Dapat ditempa, dibengkokkan, dan ditarik
Berdasarkan data tersebut, ikatan yang terjadi adalah ….
A. Ikatan kovalen polar
B. Ikatan kovalen non-polar
C. Ikatan logam
D. Ikatan kovalen koordinasi
E. Ikatan hidrogen
Jawaban: C
17. Pada senyawa CH4, perbedaan keelektronegatifan C dan H sangat kecil. Ikatan yang terjadi antar-molekul CH4 adalah ikatan ….
A. Ion
B. Kovalen polar
C. Hidrogen
D. Van der Waals
E. Logam
Jawaban: D
18. Berdasarkan sifat periodik unsur-unsur golongan VIA, H2O seharusnya memiliki titik didih yang lebih kecil dibandingkan titik didih H2S, H2Se, dan H2Te. Hal ini disebabkan H2O mempunyai ikatan ….
A. Kovalen
B. Ion
C. Hidrogen
D. Van der Waals
E. Logam
Jawaban: C
19. Suatu zat padat dilarutkan dalam air sehingga larutannya dapat menghantarkan arus listrik. Pernyataan yang benar untuk peristiwa tersebut adalah ….
A. Zat padat dalam air terurai menjadi ion-ion
B. Zat padat dalam air terurai menjadi atom
C. Zat padat dalam air terurai menjadi molekul-molekul
D. Air menjadi konduktor listrik jika ada zat terlarut di dalamnya
E. Air menjadi mudah terionisasi jika ada zat terlarut di dalamnya
Jawaban: A
20. Diketahui beberapa larutan sebagai berikut.
- HCl
- CO(NH2)2
- H3PO4
- CCl4
- CH3COOH
Larutan yang mempunyai daya hantar listrik lemah ditunjukkan oleh nomor ….
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (5)
E. (3) dan (5)
Jawaban: E
21. Larutan di bawah ini yang akan menimbulkan nyala terang pada lampu ketika dilakukan uji elektrolit adalah ….
A. Larutan HCl
B. Larutan H3PO4
C. Larutan C2H5OH
D. Larutan CH3COOH
E. Larutan C6H12O6
Jawaban: A
22. Bilangan oksidasi karbon pada C2O42- adalah ….
A. +4
B. +3
C. +2
D. -2
E. -4
Jawaban: B
23. Pada reaksi: 2H2O2 → 2H2O + O2, bilangan oksidasi oksigen berubah dari ….
A. -1 menjadi 0 dan +1
B. -1 menjadi 0 dan +2
C. -1 menjadi -2 dan 0
D. -2 menjadi -1 dan 0
E. -2 menjadi 0 dan +2
Jawaban: C
24. Raksi yang bukan merupakan reaksi redoks adalah ….
A. SiO2 → Si + O2
B. 2CO + 2NO → 2CO2 + N2
C. MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
D. CuO + 2HCl → CuCl2 + H2O
E. Mg + CuSO4 → MgSO4 + Cu
Jawaban: D
25. Perhatikan reaksi berikut.
aZnS + bHNO3 → cZnSO4 + dNO + H2O
Nilai koefisien a, b, c, dan d adalah ….
A. 2, 4, 2, dan 4
B. 3, 5, 3, dan 5
C. 3, 8, 3, dan 8
D. 4, 5, 4, dan 5
E. 4, 7, 4, dan 7
Jawaban: C
26. Perhatikan ion-ion berikut.
- K+
- Mg2+
- Ba2+
- S2-
- PO43-
Senyawa yang dapat terbentuk dari ion-ion di atas adalah ….
A. KS2
B. K3(PO4)
C. Ba2S2
D. Mg2S
E. Mg(PO4)3
Jawaban: B
27. Sebanyak 0,45 gram magnesium dibakar dengan 2,35 gram oksigen menghasilkan senyawa magnesium oksida. Pada akhir reaksi, oksigen yang tersisa sebanyak 2,15 gram. Massa magnesium oksida yang dihasilkan adalah ….
A. 0,45 gram
B. 0,55 gram
C. 0,65 gram
D. 0,75 gram
E. 0,85 gram
Jawaban: C
28. Jumlah partikel yang terdapat pada 1,12 liter O2 adalah …. Partikel.
A. 0,15 x 1023
B. 0,15 x 1022
C. 3,01 x 1025
D. 3,01 x 1022
E. 6,02 x 1023
Jawaban: D
29. Berikut ini yang mempunyai jumlah molekul terbesar adalah ….
A. 2 gram H2 (Mr = 2)
B. 4 gram CH4 (Mr = 16)
C. 4 gram N2 (Mr = 28)
D. 8 gram H2O (Mr = 18)
E. 16 gram CO2 (Mr = 44)
Jawaban: A
30. Sebanyak 22,4 liter gas ammonia (NH3) terurai menurut reaksi.
2NH3 → N2 + 3H2
Volume gas N2 pada suhu 00C dan tekanan 1 atm adalah ….
A. 0,14 liter
B. 0,70 liter
C. 5,60 liter
D. 11,20 liter
E. 14,0 liter
Jawaban: D
31. Perhatikan reaksi pembakaran batu kapur berikut.
CaCO3 → CaO + CO2
Jika pada reaksi di atas dihasilkan 22 gram gas CO2, massa unsur Ca dalam CaCO3 adalah ….
A. 100 gram
B. 80 gram
C. 60 gram
D. 40 gram
E. 20 gram
Jawaban: E
32. Sebanyak 78,4 liter gas SO2 (STP) dihasilkan melalui reaksi berikut.
S + O2 → SO3
Jumlah partikel S yang harus direaksikan adalah …. Atom.
A. 21,07 x 1023
B. 15,05 x 1023
C. 6,02 x 1023
D. 6,02 x 1022
E. 3,01 x 1023
Jawaban: A
33. Suatu kristal barium klorida (Mr = 208) mengandung 14,74% air kristal (Mr air = 18). Rumus kristal barium klorida adalah ….
A. BaCl2.2H2O
B. BaCl2.3H2O
C. BaCl2.4H2O
D. BaCl2.5H2O
E. BaCl2.6H2O
Jawaban: A
34. Banyaknya cuplikan dengan kadar belerang 80% yang dapat menghasilkan 10 gram SO3 adalah ….
A. 2 gram
B. 3 gram
C. 4 gram
D. 5 gram
E. 6 gram
Jawaban: D
35. Fraksi mol larutan 18% glukosa (Mr = 180) dalam air (Mr = 18) adalah ….
A. 0,011
B. 0,022
C. 0,033
D. 0,044
E. 0,055
Jawaban: B
36. Massa atom relatif menyatakan perbandingan ….
A. Massa 1 atom unsur terhadap massa 1 atom C-12
B. Massa 1 molekul unsur terhadap massa 1 atom C-12
C. Massa 1 atom unsur terhadap massa 1/12 atom C-12
D. Massa rata-rata unsur 1 molekul unsur terhadap 1/12 massa 1 atom C-12
E. Massa rata-rata unsur terhadap ½ massa 1 atom C-12
Jawaban: C
37. Massa molekul relatif (Mr) senyawa NaOH adalah ….
(Ar, O = 16, H = 1, Na = 23)
A. 20
B. 30
C. 40
D. 50
E. 60
Jawaban: C
38. Jumlah mol dari 12 gram CO(NH2)2 adalah …. (Ar C = 12; O = 16; N = 14; H = 1)
A. 0,05 mol
B. 0,10 mol
C. 0,20 mol
D. 0,25 mol
E. 0,50 mol
Jawaban: C
39. Zat-zat berikut yang mengandung jumlah molekul terkecil adalah ….
A. 4 gram N2 (Mr = 28)
B. 16 gram O2 (Mr = 32)
C. 23 gram NO2 (Mr = 46)
D. 4 gram CH4 (Mr = 16)
E. 2 gram H2 (Mr = 2)
Jawaban: A
40. Massa dari 0,5 mol gas SO2 (Ar S = 32; O = 16) adalah ….
A. 24 gram
B. 32 gram
C. 48 gram
D. 64 gram
E. 96 gram
Jawaban: B
B. Soal Essai
41. Diketahui konfigurasi elektron masing-masing unsur sebagai berikut.
X = 1s2 2s2 2p3
Y = 1s2 2s2 2p6 3s1
Z = 1s2 2s2 2p6 3s2 3p6 3d3 4s2
Tentukan:
- Nilai keempat bilangan kuantum elektron terakhirnya
- Golongan dan periode unsur tersebut dalam sistem periodik.
Jawaban:
42. Jelaskan terjadinya ikatan hidrogen beserta contohnya dan pengaruh ikatan hidrogen terhadap titik didih dan titik lebur senyawa.
Jawaban:
43. Perhatikan senyawa-senyawa berikut.
- NaCl
- CCl4
- H2O
- HCl
- NH3
Kelompokkan senyawa-senyawa tersebut berdasarkan hal berikut.
- Senyawa yang termasuk ikatan ion, ikatan kovalen, dan ikatan kovalen non-polar
- Senyawa yang dapat menghantarkan listrik dalam bentuk padatan
- Senyawa yang dapat menghantarkan listrik dalam bentuk lelehan dan larutan.
- Senyawa yang tidak dapat menghantarkan listrik
Jawaban:
44. Tentukan zat yang bertindak sebagai oksidator dan reduktor pada reaksi-reaksi redoks berikut.
- Al + FeCl3 → Fe + AlCl3
- H2S + 2H2O + 3Cl2 → SO2 + 6HCl
- 2MnO4– + 10Cl– + 16H+ → 2Mn2+ + 5Cl2 + 8H2O
Jawaban:
45. Sebanyak 2,86 gram kristal natrium karbonat (Na2CO3.xH2O) dipanaskan. Zat yang tersisa setelah pemanasan adalah 1,06 gram. Tentukan rumus hidrat senyawa tersebut.
Jawaban: