Soal No. 11
Pada reaksi:
2Ag+(aq) + Zn(s) → 2Ag(s) + Zn2+(aq)
yang benar adalah ….
A. Zn sebagai oksidator dan Ag reduktor
B. Zn sebagai oksidator dan Ag+ reduktor
C. Zn sebagai reduktor dan Ag oksidator
D. Zn sebagai reduktor dan Ag+ oksidator
E. Zn2+ sebagai reduktor dan Ag+ oksidator
Jawaban: D
Pembahasan:
Soal No. 12
Di antara spesi yang dicetak miring di bawah ini, yang merupakan oksidator adalah ….
A. 2Ag++ Cu → 2Ag + Cu2+
B. 2I–+Cl2 → I2 + 2Cl–
C. Sn2++ 2Fe3+ → Sn4+ + 2Fe2+
D. 5I–+ IO3– + 6H+ → 3I2 + 3H2O
E. Fe + 2H+ → Fe2+ + H2
Jawaban: A
Pembahasan:
Oksidator adalah zat yang mengalami penurunan bilangan oksidasi. Jika kita lihat setiap unsur dan ion yang dicetak miring maka perubahan bilangan oksidasinya sebagai berikut:
- Ag dari +1 menjadi 0 [biloks turun]
- I dari -1 menjadi 0 [biloks naik]
- Sn dari +2 menjadi +4 [biloks naik]
- I dari -1 menjadi 0 [biloks naik]
- Fe dari 0 menjadi +2 [biloks naik]
Soal No. 13
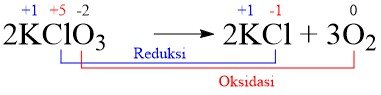
Pada persamaan KClO3 terjadi reaksi:
2KClO3(s) → 2KCl(s) + 3O2(g)
Peristiwa oksidasi terjadi pada ….
A. Atom Cl pada KClO3 menjadi KCl
B. Atom K pada KClO3 menjadi KCl
C. Atom O pada KClO3 menjadi KCl
D. Atom O pada KClO3 menjadi O2
E. Atom Cl pada KCl menjadi KClO3
Jawaban: D
Pembahasan:
Soal No. 14
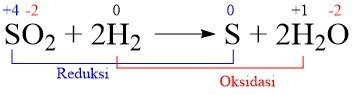
Reaksi yang menunjukkan reduksi atom S adalah ….
A. 2S + 3O2 → 2SO3
B. H2S + ½ O2 → SO2 + H2O
C. 3SO32- + 2NO3– + 2H+ → 3SO42- + 2NO + H2O
D. 2S2O32- + I2 → S4O62- + 2I–
E. SO2 + 2H2 → S + 2H2O
Jawaban: E
Pembahasan:
Soal No. 15
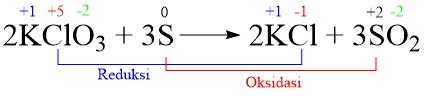
Dalam reaksi:
2KClO3(s) + 3S(s) → 2KCl(s) + 3SO2(g)
yang bertindak sebagai oksidator adalah ….
A. KClO3
B. S
C. KCl dan SO2
D. KCl
E. SO2
Jawaban: A
Pembahasan:
Oksidator adalah zat yang mengalami penurunan bilangan oksidasi dan menaikkan bilangan oksidasi zat lain. Jadi oksidatornya adalah KClO3.
Soal No. 16
Perubahan bilangan oksidasi atom N pada reaksi:
CuS + NO3– → Cu2+ + SO42- + NO
adalah ….
A. naik 1
B. naik 2
C. naik 3
D. turun 2
E. turun 3
Jawaban: E
Pembahasan:
NO3– = biloks N + 3biloks O
-1 = N + (3 x (-2))
-1 = N – 6
N = +5
NO = biloks N + bilok O
0 = N – 2
N = +2
Soal No. 17
Bilangan oksidasi atom N = -3 terdapat pada senawa ….
A. NH3
B. HNO3
C. N2O4
D. N2H4
E. HNO2
Jawaban: A
Pembahasan:
A. NH3
NH3 = biloks N + 3biloks H
0 = N + (3 x 1)
N = -3
B. HNO3
HNO3 = biloks H + biloks N + 3biloks O
0 = 1 + N + (3 x (-2))
0 = 1 + N – 6
N = +5
C. N2O4
N2O4 = 2biloks N + 4biloks O
0 = 2N + (4 x (-2))
0 = 2N – 8
2N = 8
N = 8/2 = +4
D. N2H4
N2H4 = 2biloks N + 4biloks H
0 = 2N + (4 x 1)
0 = 2N + 4
N = -4/2 = -2
E. HNO2
HNO2 = biloks H + biloks N + 2biloks O
0 = 1 + N + (2 x (-2))
0 = 1 + N – 4
N = +3
Soal No. 18
Senyawa krom yang bertindak sebagai reduktor terdapat pada reaksi ….
A. Cr2O72- + Fe2+ → Cr3+ + Fe3+
B. Cr2O3 + HCl → CrCl3 + H2O
C. Cr2(SO4)3 + FeSO4 → CrSO4 + Fe2(SO4)3
D. Cr + HNO3 → Cr(NO3)3 + NO + H2O
E. Cr2O72- + Sn2+ → Cr3+ + Sn4+
Jawaban: D
Pembahasan:
Pada reaksi Cr + HNO3 → Cr(NO3)3 + NO + H2O
Biloks Cr dalam Cr = 0
Biloks Cr dalam Cr(NO3)3 = +3
Jadi, Cr mengalami oksidasi dan berperan sebagai reduktor.
Soal No. 19
Bilangan oksidasi Cr dalam K2Cr2O7 adalah …..
A. +12
B. +8
C. +6
D. -8
E. -12
Jawaban: C
Pembahasan:
K2Cr2O7 = 2 biloks K + 2 biloks Cr + 7 biloks O
0 = (2 x 1) + 2Cr + (7 x (-2))
0 = 2 + 2Cr – 14
0 = 2Cr – 12
Cr = 12/2 = +6
Soal No. 20
Oksidator dan reduktor pada reaksi redoks:
Cr2O72- + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O
adalah ….
A. Cr2O72- dan Fe2+
B. Fe2+ dan Fe3+
C. Cr2O72- dan Cr3+
D. Fe2+ dan Cr3+
E. Fe2+ dan Cr2O72-
Jawaban: A