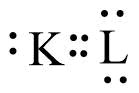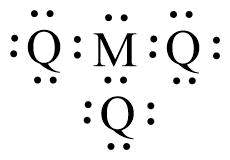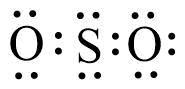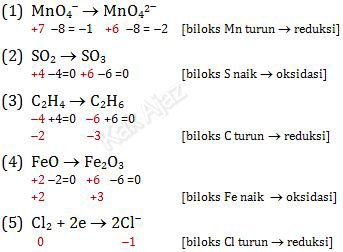Soal No. 1
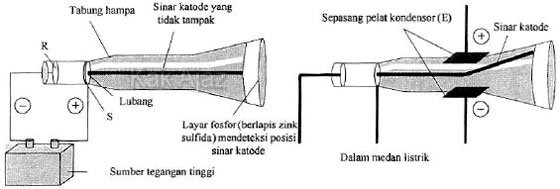
Perhatikan diagram percobaan Thomson berikut!
Berdasarkan diagram tersebut, pernyataan yang tepat tentang sinar katoda adalah ….
A. sinar katoda yang dihasilkan tergantung dari zatnya
B. sinar katoda dibelokkan ke pelat logam positif
C. sinar katoda bergerak dari S ke R
D. muatan elektron 1,6.10-9 Coulomb
E. sinar katoda tidak dibelokkan medan magnet
Pembahasan:
Sinar katoda merupakan partikel bermuatan negatif. Sehingga, sinar katoda dibelokkan ke pelat logam positif.
Jadi, pernyataan yang tepat tentang sinar katoda adalah sinar katoda dibelokkan ke pelat logam positif. Jawaban B.
Soal No. 2
Massa rata-rata satu atom unsur Q adalah 2,654.10-23 gr dan massa satu atom karbon (C12) adalah 1,993.10-23 gram. Massa atom relatif (Ar) Q adalah ….
A.
B.
C.
D.
E.
Pembahasan:
Diketahui:
massa rata-rata 1 atom = 2,654.10-23 gram
massa 1 atom C12 = 1,993.10-23
Ditanya: Ar ….?
Jawaban:
Jadi, Massa atom relatif (Ar) Q adalah jawaban yang benar adalah . Jawaban C.
Soal No. 3
Diagram susunan partikel dari unsur A dan B adalah sebagai berikut:
Berdasarkan diagram tersebut, notasi unsur A dan B yang benar adalah ….
A. 11A23 dan 15B30
B. 13A27 dan 17B35
C. 13A26 dan 17B34
D. 27A13 dan 35B17
E. 27A13 dan 15B30
Pembahasan:
Diketahui: p A = 13, n A = 14
p B = 17, n B = 18
Ditanya: notasi unsur A dan B ….?
Jawaban:
untuk mengetahui notasi A dan B, kita ingat kembali rumus notasi, yaitu:
ZXA
masih ingat kan?
Z = nomor atom = jumlah proton
A = nomor massa = jumlah proton + neutron
Notasi Unsur A
Z = p = 13
A = p + n = 13 + 14 = 27
Notasi: 13A27
Notasi Unsur B
Z = p = 17
A = p + n = 17 + 18 = 35
Notasi: 17B35
Jadi, berdasarkan diagram tersebut, notasi unsur A dan B yang benar adalah jawaban yang benar adalah 13A27 dan 17B35. Jawaban B.
Soal No. 4
Perhatikan data afinitas elektron berikut!
| Unsur | Afinitas Elektron |
| X | 240 kJ.mol-1 |
| Y | -349 kJ.mol-1 |
Pernyataan yang tepat untuk kedua unsur tersebut dalam mencapai kestabilan adalah ….
A. ion X– lebih stabil daripada atom X
B. ion Y– lebih stabil daripada atom Y
C. Y lebih mudah melepas elektron daripada X
D. X lebih bersifat nonlogam daripada Y
E. X lebih mudah menarik elektron daripada Y
Pembahasan:
Unsur yang mempunyai afinitas elektron negatif, mempunyai kecenderungan lebih besar dalam menerima elektron dan membentuk ion negatif.
Jadi, pernyataan yang tepat untuk kedua unsur tersebut dalam mencapai kestabilan adalah ion Y– lebih stabil daripada atom Y. Jawaban B.
Soal No. 5
Pasangan senyawa dari unsur-unsur berikut: 6K, 8L, 15M, 17Q, 9R, yang memenuhi aturan oktet, kecuali ….
A. KL2 dan KQ4
B. KQ4 dan Q2L
C. MQ5 dan KL
D. MQ3 dan KR4
E. KQ4 dan KL2
Pembahasan:
untuk menjawab soal semacam ini, kita perlu mengidentifikasi senyawa yang bersangkutan satu-persatu. Mari kita eksekusi!
Kita cari dulu elektron valensi dari setiap unsur yang bersangkutan:
6K = 2 4
8L = 2 6
15M= 2 8 5
17Q = 2 8 7
9R = 2 7
Selanjutnya, kita tuliskan struktur lewisnya:
Option A. KL2 dan KQ4
KL2
![]() berdasarkan struktur tersebut dapat kita lihat jika KL2 memenuhi aturan oktet.
berdasarkan struktur tersebut dapat kita lihat jika KL2 memenuhi aturan oktet.
KQ4
berdasarkan struktur tersebut dapat kita lihat jika KQ4 memenuhi aturan oktet.
Option B. KQ4 dan Q2L
Q2L
berdasarkan struktur tersebut dapat kita lihat jika Q2L memenuhi aturan oktet.
Option C. MQ5 dan KL
MQ5
berdasarkan struktur tersebut dapat kita lihat jika MQ5 tidak memenuhi aturan oktet.
KL
berdasarkan struktur tersebut dapat kita lihat jika KL tidak memenuhi aturan oktet.
Option D. MQ3 dan KR4
MQ3
berdasarkan struktur tersebut dapat kita lihat jika MQ3 memenuhi aturan oktet.
KR4
berdasarkan struktur tersebut dapat kita lihat jika KR4 memenuhi aturan oktet.
E. KQ4 dan KL2 (memenuhi aturan oktet)
Jadi, pasangan senyawa yang tidak memenuhi aturan oktet adalah MQ5 dan KL. Jawaban C.
Soal No. 6
Perhatikan data hasil percobaan berikut!
| Zat | Titik Leleh (0C) | Kelarutan dalam Ari | Daya Hantar | |
| Padatan | Lelehan | |||
| V | 1.070 | tidak larut | menghantarkan | menghantarkan |
| X | -6 | tidak larut | tidak menghantarkan | tidak menghantarkan |
Jenis ikatan yang terdapat pada zat V dan X secara berturut-turut adalah ….
A. ikatan logam dan ikatan ion
B. ikatan logam dan kovalen polar
C. ikatan kovalen polar dan kovalen nonpolar
D. ikatan logam dan ikatan kovalen nonpolar
E. ikatan ion dan kovalen nonpolar
Pembahasan:
Berdasarkan tabel dapat kita lihat zat V mempunyai titik leleh di atas 800 0C yaitu sebesar 1.070 0C, tidak larut dalam air, dan dapat menghantarkan listrik dalam setiap fase. Itu artinya, V merupakan zat yang memiliki ikatan logam. Sedangkan zat X mempunyai titik leleh di bawah 800 0C yaitu sebesar 6 0C, tidak larut dalam air, dan tidak dapat menghantarkan listrik dalam setiap fase. Itu artinya, X merupakan zat yang memiliki ikatan kovalen nonpolar.
Jadi, jenis ikatan yang terdapat pada zat V dan X secara berturut-turut adalah jawaban yang benar adalah ikatan logam dan ikatan kovalen nonpolar. Jawaban D.
Soal No. 7
Gambar struktur Lewis senyawa SO2 yang paling tepat adalah … (nomor atom S = 16; O = 8).
Pembahasan:
Untuk dapat mengetahui struktur lewis senyawa SO2, kita harus menentukan elektron valensi dari S dan O, yaitu:
16S = 2 8 6
8O = 2 6
seperti kita lihat, kedua unsur sama-sama memerlukan 2 elektron lagi untuk stabil. Sehingga, Struktur Lewisnya:
Jawaban B.
Soal No. 8
Konfigurasi elektron dari unsur D dan E.
D = [He] 2s2 2p5
E = [Ne] 3s2 3p3
Rumus kimia dan bentuk molekul yang terbentuk jika kedua unsur tersebut berikatan adalah …
A. ED, linear
B. ED5, bipiramida trigonal
C. E2D, linear
D. ED2, planar bentuk V
E. E4D, tetrahedron
Pembahasan:
Kita tentukan dulu elektron valensinya:
D = [He] 2s2 2p5
E = [Ne] 3s2 3p3
itu artinya, D memiliki 7 elektron valensi dan E memiliki 5 elektron valensi. Supaya D stabil, D membutuhkan 1 elektron dan supaya E stabi, E membutuhkan 3 elektron. Jika D dan E berikatan, maka akan membentuk ikatan ED3 dengan bentuk molekul trigonal piramida atau ED5 dengan bentuk molekul bipiramida trigonal.
Jadi, rumus kimia dan bentuk molekul yang terbentuk jika kedua unsur tersebut berikatan adalah ED5, bipiramida trigonal. Jawaban B
Soal No. 9
Diberikan lima persamaan reaksi oksidasi atau reduksi yang belum setara.
- MnO4– → MnO42-
- SO2 → SO3
- C2H4 → C2H6
- FeO → Fe2O3
- Cl2 + 2e → 2Cl–
Kelompok persamaan reaksi yang mengalami reduksi ditunjukkan oleh nomor ….
A. (1), (2), dan (3)
B. (1), (3), dan (4)
C. (1), (3), dan (5)
D. (2), (3), dan (4)
E. (2), (3), dan (5)
Pembahasan:
Jadi, kelompok persamaan reaksi yang mengalami reduksi ditunjukkan oleh nomor 1, 3, dan 5. Jawaban C.
Soal No. 10
Perhatikan persamaan reaksi redoks berikut!
Sn(s) + 4HNO3(aq) → SnO2(s) + 4NO2(g) + 2H2O(l)
Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ….
A. +1, Sn
B. +1, SnO2
C. +4, NO2
D. +5, NO2
E. +5, HNO3
Pembahasan:
Dari reaksi dapat kita lihat, bahwa bilangan oksidasi dari zat oksidator sebesar +5 dan hasilnya adalah NO2.
Jadi, bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah jawaban yang benar adalah +5, NO2. Jawaban D.
Pelajari Juga: