Pereaksi pembatas adalah pereaksi yang habis terlebih dahulu sebelum pereaksi yang lainnya habis. Contoh penerapan peraksi pembatas dalam kehidupan sehari-hari yaitu:
1. Pembakaran Gas Propana
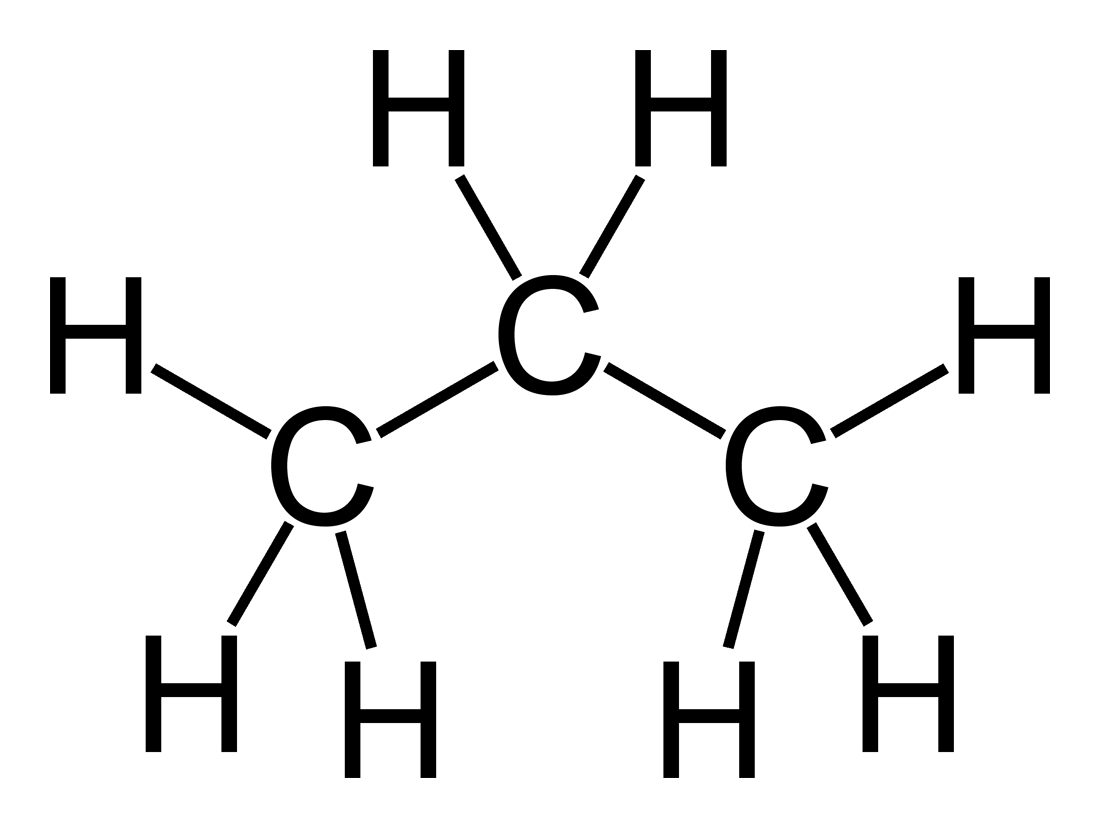
Reaksi pembakaran:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)
Dalam persamaan reaksi pembakaran propana di atas, menyatakan bahwa 2 mol C3H8 tepat habis terbakar dengan 5 mol O2. Namun kenyataannya, gas oksigen yang dapat membakar gas propana sangatlah melimpah di lingkungan, sehingga ketika gas propana habis terbakar maka gas oksigen tidak habis, melainkan masih meninggalkan sisa.
Gas propana ini yang bertindak sebagai pereaksi pembatas dan gas oksigen sebagai pereaksi sisa.
2. Sistem Pencernaan Makanan
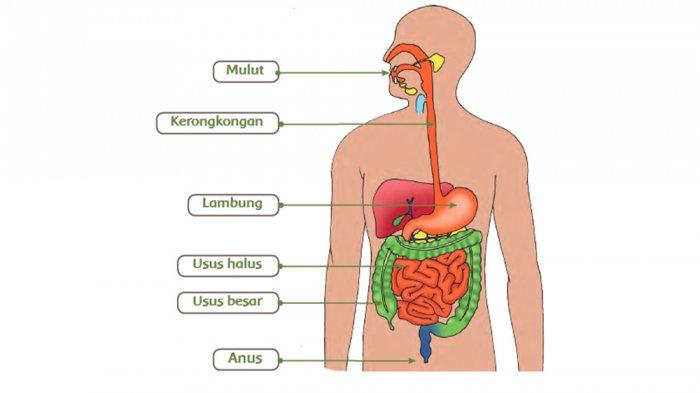
Di dalam sistem penceranaan terdapat senyawa asam lambung yang bertugas menghancurkan makanan. Namun, asam lambung diproduksi oleh tubuh secara terbatas sehingga makanan yang masuk ke dalam tubuh tidak tercerna sepenuhnya dan menyisahkan zat sisa yang disebut dengan tinja.
Asam lambung inilah yang berperan sebagai pereaksi pembatas dan makanan sebagai pereaksi sisa.
3. Reaksi Obat dalam Tubuh

Obat yang dikonsumsi oleh makhluk hidup akan bereaksi menjadi zat aktif dan zat sisa. Zat aktif berguna untuk mengobati penyakit sedangkan komponen yang tidak diperlukan oleh tubuh akan menjadi zat sisa dan dikeluarkan oleh tubuh.
Zat aktif inilah yang berperan sebagai pereaksi pembatas dan komponen yang tidak diperlukan oleh tubuh berperan sebagai pereaksi sisa.
4. Pembakaran Tidak Sempurna

Pembakaran yang sempurna akan menghasilkan karbon dioksida dan uap air. Namun ketika proses pembakaran yang berlangsung tidaklah sempurna, maka akan terbentuk senyawa karbon monoksida (CO) yang sangat beracun. Hal ini dapat terjadi karena konsentrasi oksigen yang digunakan untuk membakar gas tersebut tidaklah mencukupi.
Dalam kasus ini, oksigen berperan sebagai pereaksi pembatas dan karbon monoksida berperan sebagai sisa dari pereaksi sisa (misalnya: gas metana).
5. Pembentukan Tembaga Sulfida
Tembaga sulfida dapat dibentuk dengan mereaksikan tembaga dan belerang, menurut reaksi kimia berikut:
Cu(s) + S(s) → CuS(s)
Setiap 1 mol tembaga harus direaksikan dengan 1 mol belerang untuk menghasilkan 1 mol tembaga sulfida. Itu artinya, perbandingan komposisi antara tembaga dan belerang haruslah sama. Namun, ketika dalam pembuatan tembaga sulfida salah satu unsur penyusunnya mempunyai konsentrasi yang lebih banyak maka unsur yang konsentrasinya lebih sedikit akan menjadi pereaksi pembatas dan unsur yang konsentrasinya lebih banyak akan berperan sebagai pereaksi berlebih.