Bilangan kuantum adalah sebuah istilah untuk menggambarkan letak elektron-elektron dalam atom. Berdasarkan teori mekanika kuantum, macam macam bilangan kuantum terbagi ke dalam bilangan kuantum utama (n), bilangan kuantum azimut (l), bilangan kuantum magnetik (m), dan bilangan kuantum spin (s).
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) dinyatakan juga sebagai kulit orbital. Kulit-kulit orbital diberi nomor dari n=1 hingga tak terhingga dan disimbolkan dengan huruf yang dimulai dari K, L, M, N, dan seterusnya. Bilangan kuantum utama terikat erat dengan jarak elektron dari inti. Jadi, semakin besar nilai bilangan kuantum utama, maka jaraknya dengan inti semakin jauh.
2. Bilangan Kuantum Azimuth (l)
Bilangan kuantum azimuth menggambarkan bentuk orbital dan tingkat energi. Biar lebih mudah memahaminya, perhatikan tabel berikut:
| Kulit Ke | Orbital | Bilangan Kuantum Azimuth (l) |
| 1 (K) | 1s | 0 |
| 2 (L) | 2s, 2p | 0, 1 |
| 3 (M) | 3s, 3p, 3d | 0, 1, 2 |
| 4 (N) | 4s, 4p, 4d, 4f | 0, 1, 2, 3 |
| Dst | Dst | Dst |
3. Bilangan Kuantum Magnegik (m)
Bilangan kuantum magnetik (m) membagi bilangan kuantum Azimuth kedalam orbital-orbital yang lebih kompleks. Perhatikan tabel bilangan kuantum berikut:
| Bilangan Kuantum Utama (n) | Bilangan Kuantum Azimuth (l) | Bilangan Kuantum Magnetik (m) | Jumlah Orbital |
| 1 (K) | 1s | 0 | 1 |
| 2 (L) | 2s | 0 | 1 |
| 2p | -1, 0, +1 | 3 | |
| 3 (M) | 3s | 0 | 1 |
| 3p | -1, 0, +1 | 3 | |
| 3d | -2, -1, 0, +1, +2 | 5 | |
| 4 (N) | 4s | 0 | 1 |
| 4p | -1, 0, +1 | 3 | |
| 4d | -2, -1, 0, +1, +2 | 5 | |
| 4f | -3, -2, -1, 0, +1, +2, +3 | 7 |
4. Bilangan Kuantum Spin (s)
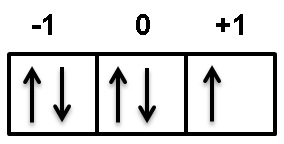
Bilangan kuantum spin (s) merupakan aturan dasar pengisian elektron dalam orbital dan menggambarkan perputaran dari sebuah elektron pada sumbunya. Arah perputaran elektron ini bisa mengikuti arah perputaran jarum jam dan berlawanan dengan arah perputaran jarum jam. Arah perputaran yang mengikuti perputaran jarum jam diberi notasi +½ atau ↑ sedangkan arah perputaran elektron yang berlawanan dengan arah perputaran jarum jam diberi notasi -½ atau ↓. Perhatikan contoh bilangan kuantum spin berikut ini:
Karena bilangan kuantum spin merupakan aturan dasar pengisian elektron, maka setiap orbital dari bilangan kuantum magnetik diisikan dengan bilangan kuantum spin yang mengikuti arah perputaran jarum jam (↑), setelah semua terisi dengann bilangan kuantum spin +½ atau ↑, dilanjutkan dengan pengisian bilangan kuantum spin yang berlawanan dengan arah perputaran jarum jam (↓). Jumlah pengisiannya disesuaikan dengan tingkat energi dalam bilangan kuantum Azimuth.