Pembahasan Soal SBMPTN 2017 Saintek Nomor 41-45
Soal No. 41
Pada temperatur tertentu, Ksp PbSO4 dan PbI2 berturut-turut adalah 1,6 × 10−8 dan 7,1 × 10−9. Pada temperatur tersebut ….
A. PbSO4 mudah larut dibandingkan PbI2
B. diperlukan lebih banyak SO42− daripada I− untuk mendapatkan Pb2+ dari dalam larutan
C. kelarutan PbSO4 sama dengan kelarutan PbI2
D. kelarutan PbSO4 lebih besar daripada kelarutan PbI2
E. kelarutan PbI2 lebih besar daripada kelarutan PbSO4
Jawaban: E
Pembahasan:
Untuk senyawa XmYn berlaku
Sehingga, kelarutan PbSO4 dan PbI2 berturut-turut adalah sebagai berikut:
itu artinya, kelarutan PbI2 lebih besar daripada kelarutan PbSO4
Soal No. 42
Oksidasi 2-metil-1-propanol dengan asam bikromat menghasilkan ….
A. butanadiol
B. butanon
C. 2-metilpropanon
D. asam 2-metilpropanoat
E. metilpropanoat
Jawaban: D
Soal No. 43
Dari keempat reaksi (belum setara) berikut, yang merupakan reaksi reduksi-oksidasi adalah ….
- Ca(OH)2(aq) + H2SO4(aq) → CaSO4(s) + H2O(l)
- Pb(s) + H2SO4(aq) + PbO2(s) → PbSO4(s) + H2O(l)
- H2S(aq) + CdCl2(s) → HCl(aq) + CdS(s)
- NaCl(aq) + F2(g) → NaF(aq) + Cl2(g)
A. 1 dan 2
B. 2 dan 3
C. 2 dan 4
D. 3 dan 4
E. 1 dan 4
Jawaban: C
Pembahasan:
Reaksi reduksi-oksidasi dapat dengan mudah kita tentukan hanya dengan melihat persamaan reaksinya, jika persamaan reaksi kimianya berbentuk senyawa (bukan ion). Caranya yaitu, dengan mencari unsur tunggal (contohnya: Na, Cl) atau molekul unsur (Contohnya: H2) dalam reaksi kimia yang bersangkutan. Jika terdapat salah satu atau keduanya maka reaksi tersebut merupakan reaksi reduksi oksidas (redoks).
Soal No. 44
Elektrolisis 100 mL larutan CuSO4 0,1 M dalam bejana A dan 100 mL larutan AgNO3dalam bejana B dilakukan seri menggunakan arus tetap 1 A pada anoda dan katoda Pt. Pada tiap-tiap katoda terbentuk endapan Cu dan Ag sementara pada anoda dihasilkan gas O2 (Ar Cu = 63,5; Ar Ag = 108; dan konstanta Faraday = 96.500 C/mol). Setelah elektrolisis berlangsung 60 detik ….
- massa Cu yang mengendap lebih besar daripada massa Ag
- jumlah atom Cu yang mengendap sama dengan jumlah atom Ag.
- Volume gas O2 yang dihasilkan pada bejana A lebih besar daripada volume gas O2 yang dihasilkan pada bejana B
- pH larutan dalam bejana A sama dengan pH larutan dalam bejana B
Pernyataan yang benar adalah ….
A. 1, 2, 3
B. 1, 3
C. 2, 4
D. 4
E. 1, 2, 3, 4
Jawaban: D
Pembahasan:
Reaksi kimia yang terjadi:
Bejana A
katoda : Cu2+ + 2e → Cu
anoda : 2H2O → 4H+ + O2 + 4e
Bejana B
katoda : Ag+ + e → Ag
anoda : 2H2O → 4H+ + O2 + 4e
Selanjutnya, kita cari perbandingan massa Cu dan Ag:
Massa Cu (Ar = 63,5; n = 2)
wCu = Ar. i.t / n.96500
wCu = 63,5 x 1 x 60 / 2 x 96500 = 0,0197 gr
Massa Ag (Ar = 108; n = 1)
wAg = Ar. i. t / n . 96500
wAg = 108 x 1 x 60 / 1 x 96500 = 0,0671 gr
Itu artinya, massa Ag > massa Cu. (Opsi 1 salah)
Kemudian kita cari jumlah partikel Cu dan Ag
n Cu = p Cu/L
gr/Ar Cu = p Cu/L
p Cu = gr / Ar Cu x L
p Cu = 0,0197 / 63,5 x 6,02.1023 = 1,87 x 1020
n Ag = p Ag/L
gr/Ar Ag = p Ag/L
p Ag= gr/Ar Agr x L
p Ag = 0,0671/108 x 6,02.1023 = 3,73 x 1020
Itu artinya, jumlah partikel Ag yang mengendap lebih banyak daripada jumlah partikel Cu. (Opsi 2 salah)
Soal No. 45
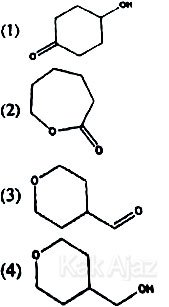
Senyawa yang merupakan isomer dari asam siklopentilmetanoat adalah ….
A. 1, 2, 3
B. 1, 3
C. 2, 4
D. 4
E. 1, 2, 3, 4
Jawaban: A
Pembahasan:
Asam Siklopentilmetanoat memiliki rumus kimia C6H10O2. Sehingga, kita hanya perlu mencari rumus struktur mempunyai rumus kimia C6H10O2.