Perubahan entalpi reaksi (∆H) merupakan selisih entalpi akhir dengan entalpi awal, yang secara matematika dapat ditulis sebagai berikut.
∆H = H akhir – H awal
Keterangan:
∆H = perubahan entalpi (J)
H akhir = entalpi ahir (J)
H awal = entalpi awal (J)
Perlu diingat baik-baik! ∆H suatu reaksi kimia akan sama dengan kalor reaksi (q) yang diserap atau dilepas. Kalor reaksi memiliki satuan energi Joule (J) atau kalori.
∆H reaksi eksoterm dan endoterm dapat ditunjukkan dengan diagram entalpi sebagai berikut:
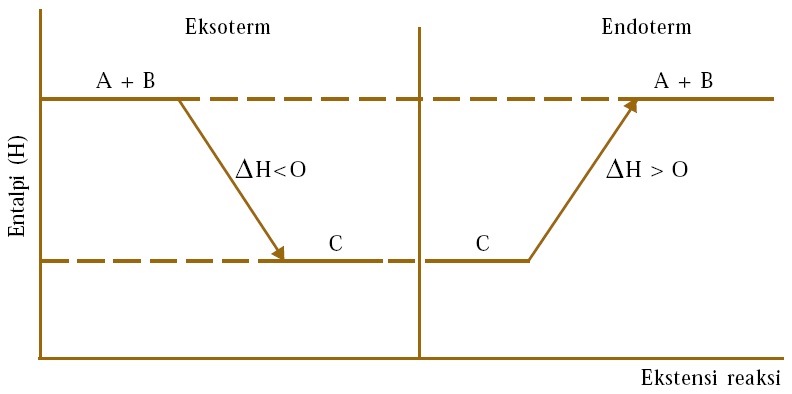
Perubahan entalpi dapat ditentukan dengan cara sederhana. Karena satuan entalpi adalah Joule (J) atau kalori, maka alat yang digunakan untuk mengukur perubahan entalpi disebut kalorimeter. Ada tiga cara untuk menentukan perubahan entalpi (∆H) reaksi, yaitu dari eksperimen dengan memakai alat kalorimeter, secara teoritis berdasarkan hukum Hess, dan dengan menghitung energi ikatan untuk melepas atau membentuk suatu ikatan.
Contoh Soal:
Diketahui data entalpi pembentukan standar:
C3H8(g) = -104 kJ/mol
CO2(g) = -394 kJ/mol
H2O(g) = -286 kJ/mol
Tentukan ∆H reaksi: C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)
Pembahasan:
∆H = H akhir – H awal
∆H = (3CO2 + 4H2O) – (C3H8 + 5O2)
∆H = (3 x (-394) + 4 x (-286)) – (-104 + 5 x 0)
∆H = – 1.182 – 1.144 + 104
∆H = – 2.222kJ = –2.222.000 J