Sistem Periodik Unsur
Sistem periodik unsur merupakan suatu cara untuk menyusun dan mengklasifikasi unsur-unsur, dimana unsur-unsur yang mirip menurut sifatnya diletakkan pada kelompok yang sama. Berikut adalah perkembangan penyusunan tabel sistem periodik unsur.
1. Triade Dobereiner
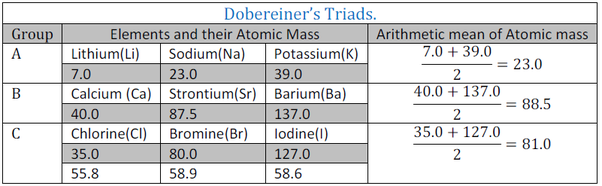
Johan W. Dobereiner (1817) adalah orang pertama yang menemukan hubungan antara sifat unsur dan massa atom relatifnya. Jika tiga unsur yang sama sifatnya disusun secara berurutan menurut bertambahnya massa atom relatif, maka:
- Massa atom relatif unsur yang kedua merupakan rata-rata massa atom relatif unsur pertama dan ketiga
- Sifat lain unsur yang kedua menunjukkan sifat antara yang pertama dan ketiga
Selanjutnya kelompok tiga unsur ini disebut “triade”.
Kelebihan Triade Dobereiner
- Adanya keteraturan setiap unsur yang sifatnya mirip
- massa atom (Ar) unsur yang kedua merupakan massa atom rata-rata unsur pertama dan ketiga
Kelemahan Triade Dobereiner
- Adanya beberapa unsur yang tidak dalam satu triade memiliki sifat yang sama.
2. Hukum Oktaf Newlands
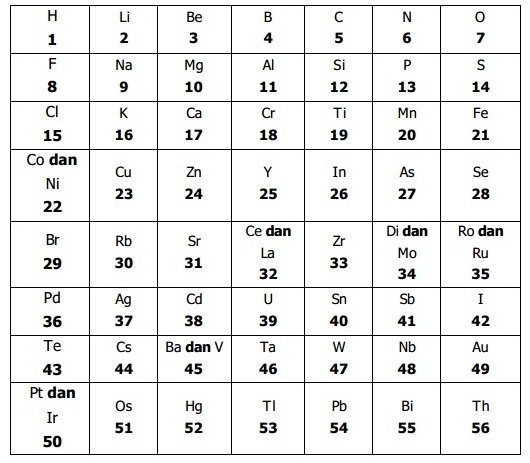
John Newlands (1865) menemukan hubungan lain antara sifat unsur dengan massa atom relatif, sesuai dengan hukum yang disebutnya “Hukum Oktaf”. Newlands menyusun unsur-unsur ke dalam kelompok tujuh unsur dan setiap unsur kedelapan mempunyai sifat yang mirip dengan unsur pertama, unsur kesembilan mirip dengan unsur kedua, dan seterusnya.
Kelemahan Hukum Oktaf Newlands
- Tidak memperhitungkan letak unsur-unsur yang belum ditemukan
- Terdapat pasangan unsur yang terpaksa ditempatkan pada satu posisi
- Hanya berlaku untuk unsur dengan Ar ringan
- Masih terdapat beberapa oktaf yang isinya lebih dari delapan unsur
3. Hukum Mendeleyev
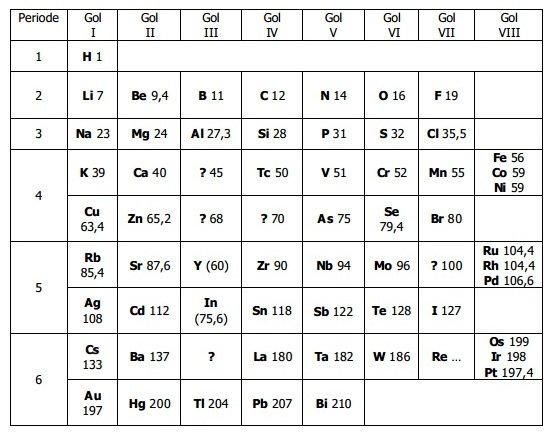
Mendeleyev mengungkapkan suatu hukum periodik yang berbunyi “Sifat unsur-unsur merupakan fungsi periodik dari massa atom relatifnya”.
Kelebihan tabel sistem periodik unsur Mendeleyev
- Sifat kimia dan sifat fisika unsur dalam satu golongan mirip dan berubah secara teratur
- Valensi tertinggi dalam suatu unsur sama dengan nomor golongannya
- Dapat meramalkan sifat unsur yang belum ditemukan, yang akan mengesi tempat kosong dalam daftar
Kelemahan tabel sistem periodik unsur Mendeleyev
- Panjang periode tidak sama
- Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya
- Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum ditemukan.
- Valensi unsur yang lebih dari satu sulit diramalkan dari golongannya
- Anomali unsur hidrogen dari unsur yang lain tidak dijelaskan.
- Triade besi (Fe, Co, dan Ni), triade platina ringan (Ru, Rh, dan Pd), dan triade platina (Os, Ir, dan Pt) dimasukkan ke dalam golongan VIII.
4. Henry Moseley

Henry Moseley melakukan percobaan menggunakan berbagai logam sebagai antikatoda pada tabung sinar X. Moseley menyimpulkan bahwa ada perubahan yang teratur dari energi sinar X sesuai dengan perubahan nomor atom dan bukan massa atom relatif. Dengan demikian hukum sistem periodik unsur menjadi:
“Sifat unsur-unsur merupakan fungsi periodik dari nomor atom”
Tabel yang dibuat Henry Moseley dikenal dengan nama tabel periodik modern atau bentuk panjang.
Bagian-bagian Tabel Sistem Periodik Unsur
A. Golongan
Golongan adalah baris vertikal pada tabel periodik unsur. Menurut aturan Amerika terdapat 8 golongan utama (A) dan 8 golongan transisi (B).
Golongan Utama (A)
- Golongan IA (Alkali)
- Golongan IIA (Alkali Tanah)
- Golongan IIIA (Boron)
- Golongan IVA (Karbon)
- Golongan VA (Nitrogen)
- Golongan VIA (Oksigen)
- Golongan VIIA (Halogen)
- Golongan VIIIA (Gas Mulia)
Golongan Transisi (B)
- Golongan IIIB
- Golongan IVB
- Golongan VB
- Golongan VIB
- Golongan VIIB
- Golongan VIIIB
- Golongan IB
- Golongan IIB
Golongan transisi terdiri dari golongan transisi luar dan transisi dalam. Transisi dalam terletak pada golongan IIIB periode 6 (lantanida) dan golongan IIIB periode 7 (aktinida).
B. Periode
Periode adalah baris horisontal pada tabel periodik unsur. Tabel periodik modern terdiri dari 7 periode.
- Periode 1 berisi 2 unsur
- Periode 2 berisi 8 unsur
- Periode 3 berisi 8 unsur
- Periode 4 berisi 18 unsur
- Periode 5 berisi 18 unsur
- Periode 6 berisi 32 unsur
- Periode 7 berisi 32 unsur (belum lengkap)