Sifat Keperiodikan Unsur
Yang dimaksud dengan sifat keperiodikan unsur adalah hubungan antara sifat-sifat suatu unsur dengan letaknya pada tabel sistem periodik unsur. Sifat-sifat periodik unsur meliputi jari-jari atom, jari-jari ion, energi ionisasi, afinitas elektron, keelektronegatifan, unsur logam dan non logam, kereaktifan, titik didih dan titik leleh.
1. Jari-jari atom

Jari-jari atom adalah jarak dari inti atom sampai ke elektron pada kulit terluar.
- Dalam satu golongan, dari atas ke bawah jari-jari atom semakin besar. Karena jumlah kulit yang dimiliki atom semakin banyak, maka kulit terluar semakin jauh dari inti atom.
- Dalam satu periode, dari kiri ke kanan jari-jari atom semakin pendek. Karena semakin kekakan jumlah proton semakin banyak seingga elektron-elektron terluar tertarik lebih dekat ke arah inti.
2. Jari-Jari Ion

- Ion bermuatan positif memiliki jari-jari lebih pendek daripada jari-jari atomnya.
- Ion bermuatan negatif memiliki jari-jari lebih panjang daripada jari-jari atomnya.
3. Energi Ionisasi

Energi ionisasi adalah energi minimum yang diperlukan suatu atom dalam wujud gas untuk melepaskan elektron terluar sehingga membentuk ion bermuatan.
- Semakin besar energi ionisasi, semakin sukar atom itu melepaskan elektron terluarnya. Maka semakin stabil atom tersebut.
- Dalam satu golongan, dari atas ke bawah energi ionisasi semakin kecil.
- Dalam satu periode, dari kiri ke kanan energi ionisasi semakin besar.
4. Afinitas Elektron
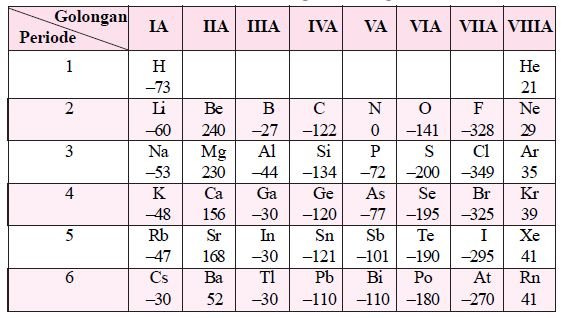
Afinitas elektron adalah energi yang dilepaskan ketika suatu atom dalam wujud gas menerima elektron. Semakin besar harga afinitas elektron suatu atom, semakin mudah unsur tersebut membentuk ion negatif.
- Dalam satu golongan, dari atas ke bawah afinitas elektron semakin kecil.
- Dalam satu periode, dari kiri ke kanan afinitas elektron semakin besar.
5. Keelektronegatifan
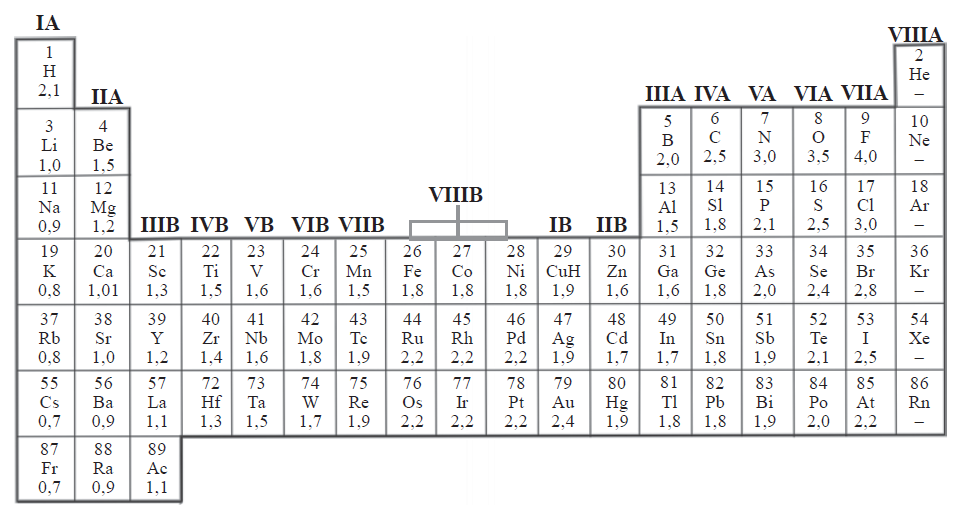
Keelektronegatifan adalh kemampuan suatu atom menarik elektron dalam suatu ikatan. Besarnya harga keelektronegatifan bersifat relatif antara suatu atom dengan atom lain. Diukur dengan skala Pauling harga keelektronegatifan berkisar antara 0,7 (Fr) – 4,0 (Fr). Semakin besar harga keelektronegatifan suatu unsur, maka semakin mudah unsur tersebut membentuk ion negatif. Dan sebaliknya, semakin besar harga keelektronegatifan suatu unsur, maka semakin sulit unsur tersebut membentuk ion negatif dan lebih mudah membentuk ion positif.
- Dalam satu golongan, dari atas ke bawah harga keelektronegatifan semakin kecil.
- Dalam satu periode, dari kiri ke kanan harga keelektronegatifan semakin besar.
6. Unsur Logam dan Non Logam
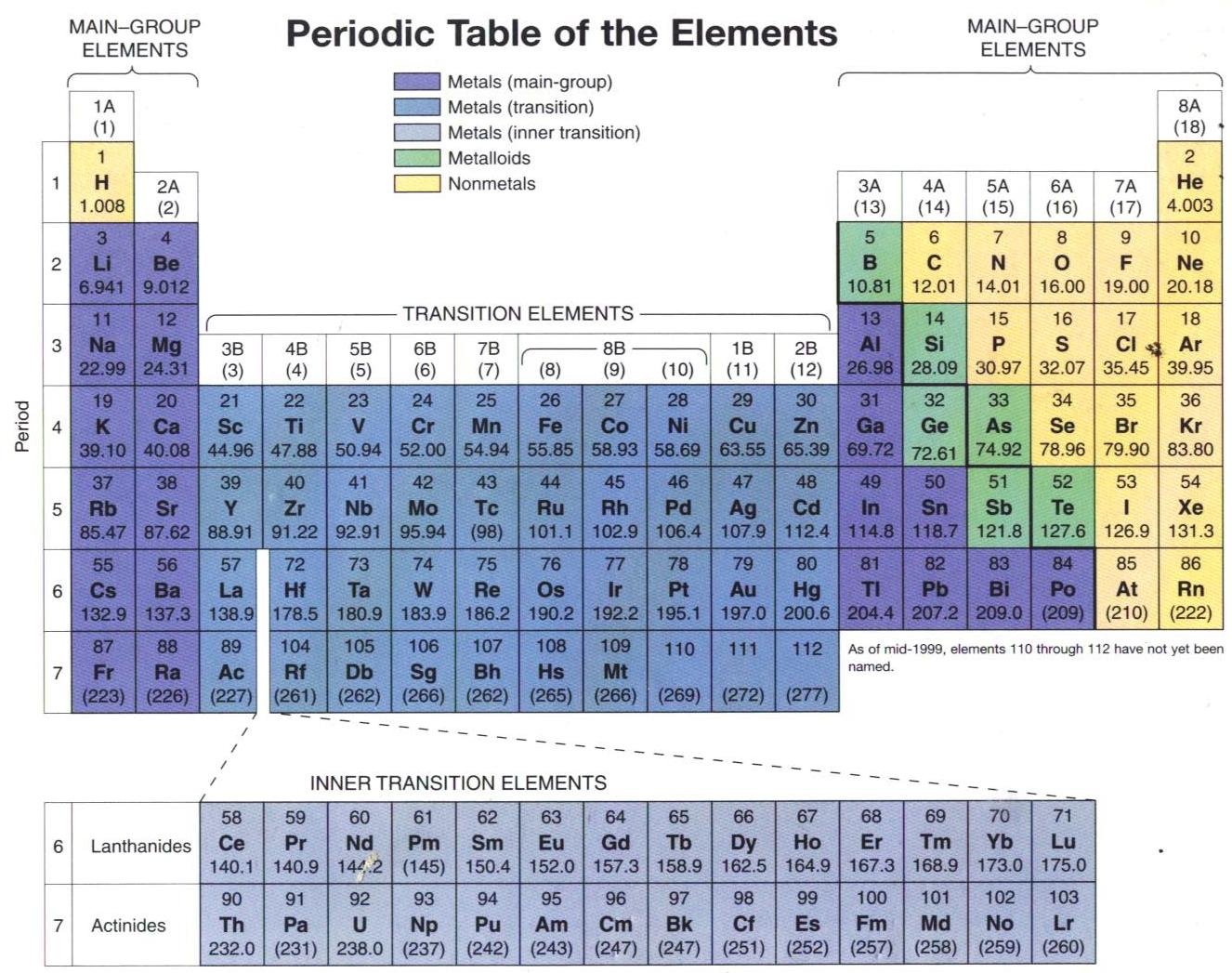
Unsur logam adalah unsur yang memiliki sifat mengkilap, konduktor, dan penghantar panas yang baik. Unsur-unsur logam memiliki ciri-ciri sebagai berikut:
- Pada suhu dan tekanan normal berwujud padat, kecuali raksa yang berwujud cair.
- Dapat ditempa menjadi benda-benda lain.
Contohnya: besi, aluminium, magnesium, kalium, dll.
Unsur non logam adalah unsur yang tidak memiliki sifat seperti logam, isolator, dan bukan penghantar panas yang baik. Unsur-unsur non logam pada suhu dan tekanan yang sama berwujud gas dan padatan.
Contohnya: helium, karbon, oksigen, dll.
Meskipun ada unsur logam dan non logam, namun batas antara ke duanya tidak begitu jelas karena ada beberapa unsur yang dapat memiliki sifat logam maupun non-logam, unsur-unsur tersebut masuk kelompok semi logam atau metaloid. Unsur metalor terletak pada garis tangga diagonal, yaitu B, Si, Ge, As, dan Te.
- Dalam satu golongan, dari atas ke bawah sifat logam semakin bertambah.
- Dalam satu periode, dari kiri ke kanan sifat logam semakin berkurang.
7. Kereaktifan
Kereaktifan suatu unsur bergantung pada kecenderungan unsur tersebut dalam melepaskan atau menarik elektron. Unsur-unsur golongan IA merupakan unsur logam yang paling reaktif dalam melepaskan elektron. Unsur-unsur golongan VIIA merupakan unsur non logam yang paling reaktif dalam menarik elektron. Unsur-unsur golongan VIIIA merupakan unsur-unsur yang paling tidak reaktif.
8. Titik Didih dan Titik Leleh
Titik didih dan titik leleh unsur-unsur logam dalam satu golongan dari atas ke bawah semakin kecil, sedangkan titik didih dan titik leleh unsur-unsur non logam dalam satu golongan dari atas ke bawah semakin besar.
Dalam satu periode dari kiri ke kanan, titik didih naik sampai maksimum golongan IIIA, kemudian turun secara teratur. Titik leleh naik sampai maksimum golongan IVA, kemudian turun secara teratur.