Sel volta menggunakan reaksi kimia spontan untuk menghasilkan arus listrik melalui sebuah lintasan eksternal. Sel ini merupakan sel yang penting, karena dasar untuk membuat baterai yang digunakan oleh masyarakat modern. Tapi bukan satu-satunya jenis sel elektrokimia. Hal ini juga memungkinkan kita untuk mengembangkan sebuah sel yang tidak bekerja pada reaksi kimia, namun menggunakan arus listrik untuk menghasilkan energi kimia. Sel ini disebut sel elektrolisis. Elektrolisis digunakan untuk menjalankan reaksi oksidasi-reduksi yang tidak terjadi secara spontan. Contohnya, elektrolisis lelehan NaCl.
Elektrolisis Lelehan NaCl
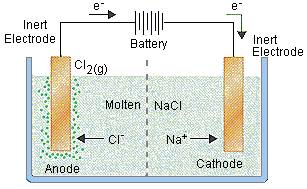
Sebuah sel ideal untuk elektrolisis natrium klorida ditunjukkan pada gambar di atas. Sebuah sumber arus searah terhubung ke sepasang elektroda inert yang tenggelam dalam lelehan natrium klorida (NaCl). Karena NaCl telah dipanaskan sampai meleleh, maka ion (Na+) mengalir menuju elektroda negatif dan ion (Cl–) mengalir menuju elektroda positif.
Ketika ion (Na+) berbenturan dengan elektroda negatif, dan tereduksi membentuk logam natrium (Na).
Katoda: Na+ + e– →Na
Ion (Cl–) yang bertabrakan dengan elektroda positif dan akan teroksidasi.
Anoda: 2Cl– → Cl2 + 2e–
Efek bersih dari arus listrik melalui lelehan NaCl dalam sel ini adalah untuk menguraikan sodium klorida (NaCl) ke dalam unsur-unsurnya, yaitu logam natrium (Na) dan gas klorin (Cl). Energi yang dibutuhkan untuk mengoksidasi ion (Cl–) menjadi (Cl2) adalah -1,36 volt dan yang dibutuhkan untuk mereduksi ion (Na+) menjadi logam natrium adalah -2,71 volt. Baterai yang digunakan untuk menjalankan reaksi ini harus memiliki energi setidaknya 4,07 volt.
Jadi reaksinya:
2NaCl(l) → 2Na(l) + Cl2–(g)