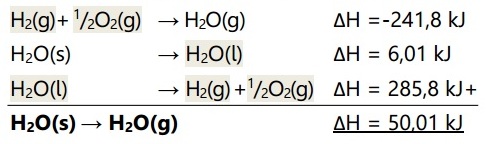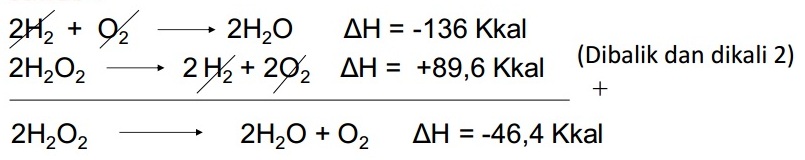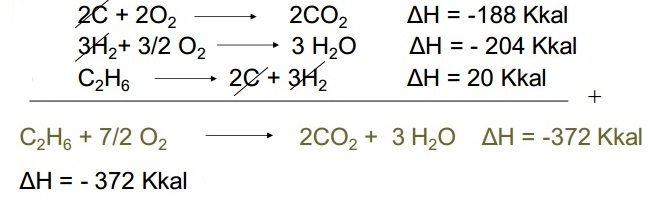Termokimia merupakan salah satu bentuk penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang perubahan kalor yang menyertai suatu reaksi kimia. Perhatikan contoh soal termokimia dan pembahasannya berikut ini supaya pemahamanmu mengenai materi termokimia semakin mendalam.
Soal No. 1
Pada pembentukan (NH4)2Cr2O7 dalam keadaan standar, dibebaskan energi sebesar 2780,08 kJ/mol, tentukan persamaan reaksi pembentukan termokimia!
Pembahasan:
N4(g) + 4H2(g) + 2Cr(s) + 3½O2(g) → (NH4)2Cr2O7(aq) ∆H0f = – 2780,08 kJ
Soal No. 2
Diketahui entalpi pembentukan standar natrium klorida adalah -410,9 kJ. Buatlah persamaan reaksi penguraian termokimianya!
Pembahasan:
NaCl(s) → Na(s) + ½ Cl2(g) ∆H0d = +410,9 kJ
Soal No. 3
Tentukan persamaan termokimia reaksi pembakaran C3H6 jika nilai ∆H0d = -2377 kJ!
Pembahasan:
C3H6(s) + 4 ½ O2(g) → 3CO2(g) + 3H2O(l) ∆H0 = -2377 kJ
Soal No. 4
Tentukan persamaan entalpi penguapan air dari wujud padat jika diketahui reaksi-reaksi berikut:
H2(g) + ½ O2(g) → H2O(g) ∆H = -241,8 kJ
H2O(l) → H2O(s) ∆H = -6,01 kJ
H2O(g) + ½ O2(g) → H2O(l) ∆H = -285,8 kJ
Pembahasan:
Soal No. 5
Tentukan entalpi reaksi berikut,
BaCl2(aq) + H2SO4(aq) → BaSO4(s) + 2HCl(aq)
Jika diketahui entalpi pembentukan standar dari BaCl2, BaSO4, H2SO4, dan HCl berturut-turut adalah -858,6 kJ/mol, -1473,3 kJ/mol, -909,27 kJ/mol, -167,1 kJ/mol
Pembahasan:
∆Hr = ∆H0f produk – ∆H0f reaktan
∆Hr = (∆H0f BaSO4 + 2∆H0f HCl) – (∆H0f BaCl2 + ∆H0f H2SO4)
∆Hr = (-1473,3 + (2 x (-167,1))) – (-858,6 + (-909,27)
∆Hr = -39,63 k/mol
Soal No. 6
Tentukan perubahan entalpi reaksi dari pembakaran CH2 dibawah ini!
CH2(g) + 1½ O2(g) → CO2(g) + H2O(g) ∆H = ?
Pembahasan:
∆Hr = ∑Eikatan putus – ∑Eikatan terbentuk
∆Hr = (CH2 + 1 ½ O2) – (CO2 + H2O)
∆Hr = ( H – C – H + 1 ½ (O = O)) – ( O = C = O + H – O – H)
∆Hr = ((2 x 413) + (1 ½ x 146)) – ((2 x 358) + (2 x 263))
∆Hr = (826 + 219) – (716 + 526) = -197 kJ
Soal No. 7
Hitung entalpi pembakaran CH4(g) menjadi CO2(g) dan H2O(g) pada temperature 298K, bila diketahui pada temperature tersebut:
- ∆H CH4 = – 74,873 kJ/mol
- ∆H O2 = 0,00 kJ/mol
- ∆H H2O = -241,827 kJ/mol
- ∆H CO2 = – 393,522 kJ/mol
Pembahasan:
Reaksi:
CH4 + 2O2 → CO2 + 2H2O
∆H = ∆H produk – ∆H reaktan
∆H = (CO2 + 2H2O) – (CH4 + 2O2)
∆H = ( – 393,522 + (2 x (-241,827)) – ( – 74,873 + (2 x 0,00))
∆H = -877,176 + 74,873 = 802,303 k/mol
Soal No. 8
Pada perubahan dari 12,425 gram karbon menjadi CO2 pada suhu reaksi semula 300C, terjadi kenaikan suhu sebesar 0,4840C. Apabila panas jenis calorimeter 200 kkal/gr0C. Berapa ∆H tiap mol karbon yang dibakar?
Pembahasan:
Reaksi:
C + O2 → CO2
n C = 12,435/12 = 1,03 mol
∆H = (kalor jenis x ∆T)/n C
∆H = (200 x 0,484)/1 = 93,414 kkal
Soal No. 9
Ke dalam calorimeter dituangkan 50 gram air dingin 250C, kemudian ditambahkan 75 gram air panas 600C sehingga suhu campuran menjadi 350C. Jika suhu calorimeter naik sebesar 70C, tentukan kapasitas kalor calorimeter? Diketahui kalor jenis air = 4,18 J.g-1.0C-1.
Pembahasan:
Q air panas = m x c x ∆T = 75 x 4,18 x (35 – 60) = – 7.837,5 J
Q air dingin = m x c x ∆T = 50 x 4,18 x (35 – 25) = + 2.090 J
Q calorimeter = c x ∆T = (c x 70C)
Q air panas + Q air dingin + Q calorimeter = 0
-7.837,5 + 2.090 + (c x 70C)= 0
-5.747,5 + c x 70C = 0
(c x 70C) = 5.747,5 J
c = 5.747,5/7 = 821 J/0C
Soal No. 10
Dalam calorimeter yang telah dikalibrasi dan terbuka direaksikan 50 gram alcohol dan 3 gram logam natrium. Jika suhu awal campuran 300C dan setelah reaksi suhunyya 750C, tentukan ∆H reaksi. Diketahui kalor jenis larutan 3,65 J/g0C, kapasitas calorimeter 150 J/0C dan suhu calorimeter naik sebesar 100C.
Pembahasan:
Q larutan = m x c x ∆T = 53 x 3,65 x 45 = 8.705,25 J
Q calorimeter = c x ∆T = 150 x 10 = 1.500 J
Q reaksi + Q larutan + Q calorimeter = 0
Q reaksi + 8.705,25 J + 1.500 J = 0
Q reaksi = – 10.205,25 J
Q reaksi = ∆H reaksi = -10.205,25 J
Soal No. 11
Diketahui:
2H2(g) + O2(g) → 2H2O(g) ∆H = -136 kkal
H2(g) + O2(g) → H2O2(g) ∆H = -44,8 kkal
Hitung ∆H untuk reaksi
2H2O2(g) → 2H2O + O2
Pembahasan:
Soal No. 12
Diketahui:
- C + O2 → CO2 ∆H = -94 kkal
- H2 + ½ O2 → H2O ∆H = -68 kkal
- 2C + 3H2 → C2H6 ∆H = -20 kkal
Berapa nilai ∆H untuk reaksi berikut!
C2H6 + 7/2 O2 → 2CO2 + 3H2O ∆H = ?
Pembahasan:
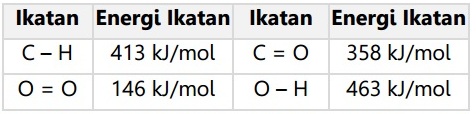
Soal No. 13
Dengan menggunakan tabel energi ikatan, tentukan energi yang dibebaskan pada pembakaran gas metana!
Pembahasan:
Reaksi pembakaran gas metana:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
∆Hr = ∑E pereaksi – ∑E produk
∆Hr = (4 x C – H + 2 O = O) – ( 2 C = O + 4 O – H )
∆Hr = (4 x 415) + (2 x 494) – (2 x 805) + (4 x 460)
∆Hr = 802 kJ
Soal No. 14
Hitung energi ikatan atom karbon dan hydrogen dalam CH4, jika reaksi pengatoman diketahui sebagai berikut.
CH4(g) → C(g) + 4H(g) ∆H = +1662 kJ
Pembahasan:
Dalam pengatoman satu mol gas menatana mengalami 4 pemutusan ikatan C – H, itu artinya
4 C – H = 1662 kJ
C – H = 1662/4 = 415,5 kJ
Jadi energi ikatan atom karbon dan hidrogen dalam CH4 sebesar 415,5 kJ
Soal No. 15
Berapa energi ikatan C – C yang dihitung dari molekul C6H6 jika diketahui reaksi pengatoman sebagai berikut.
C6H6 → 6C(g) + 6H(g) ∆H = +2924 kJ
C – H = 415,5 kJ
Pembahasan:
6 C – H + C – C = +2924 kJ
(6 x 415,5) + C – C = +2924 kJ
C – C = 2924 – 2493 = 431 kJ