Perhatikan contoh soal titrasi asam basa pilihan ganda berikut ini, supaya pemahamanmu mengenai materi titrasi asam basa semakin mendalam.
Soal No. 1
Perhatikan data hasil titrasi asam dengan larutan asam asetat 0,15 M berikut!
| Percobaan | Volume Ba(OH)2 | Volume CH3COOH 0,15 M |
| 1 | 30 mL | 39,8 mL |
| 2 | 30 mL | 40,0 mL |
| 3 | 30 mL | 40,2 mL |
Berdasarkan data tersebut, massa Ba(OH)2 yang bereaksi adalah…. (Ar Ba = 56 gram.mol–; O = 16 gram.mol–; H = 1 gram.mol–).
A. 0,54 gram
B. 0,30 gram
C. 0,27 gram
D. 0,15 gram
E. 0,10 gram
Jawaban: C
Soal No. 2
Penentuan konsentrasi suatu asam kuat dapat dilakukan dengan titrasi menggunakan basa kuat. Misalnya 50 mL larutan HCl 0,1 M dititrasi dengan larutan NaOH 0,1 M menggunakan indikator fenolftalein (PP). Titrasi dihentikan ketika larutan berubah warna menjadi merah muda secara tiba-tiba.
Alasan yang paling tepat terkait dengan terjadinya perubahan warna pada saat titrasi adalah ….
A. Volume HCl sama dengan volume NaOH
B. NaOH bersifat basa kuat sehingga larutan HCl menjadi merah
C. Larutan indikator pp akan memberikan warna merah pada larutan asam
D. Pada saat volume NaOH beerlebih maka larutan menjadi merah
E. Mol HCl = mol NaOH dan pH larutan >8,5
Jawaban: A
Soal No. 3
Perhatikan data titrasi asam basa berikut!
| No. | Volume Larutan (mL) | |
| H2SO4 xM | NaOH 0,4M | |
| 1 | 20 | 24,0 |
| 2 | 20 | 23,8 |
| 3 | 20 | 24,2 |
Kadar (%) massa H2SO4 (Mr = 98 g.mol−1) yang terdapat dalam 20 mL larutan asam sulfat tersebut jika massa jenisnya 1,8 gram/mL adalah ….
A. 0,32%
B. 0,49%
C. 0,98%
D. 1,30%
E. 4,90%
Jawaban: D
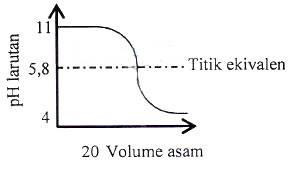
Soal No. 4
Diketahui data beberapa indikator dan trayek pH.
| Indikator | Metil Jingga | Bromtimol Biru | Fenolftalein |
| Trayek pH | 3,1 – 4,40 | 6,0 – 7,6 | 8,3 – 10,0 |
Berikut ini adalah kurva titrasi asam-basa.
Pasangan asam-basa/basa-asam dan indikator yang digunakan berturut-turut adalah ….
A. KOH – CH3COOH – fenolftalein
B. KOH – HCl – fenolftalein
C. CH3NH3 – HCl – metil jingga
D. NH4OH – CH3COOH – metil jingga
E. NaOH – HCl – fenolftalein
Jawaban: C
Soal No. 5
Indikator yang paling cocok untuk titrasi 0,1 M ammonia dengan 0,1 M HNO3 adalah…. (Kn NH3: 1,8 x 10-5)
A. Kresol merah
B. Metal merah
C. PP
D. Alizarin kuning
E. Semua bisa dipakai
Jawaban: C
Soal No. 6
Untuk menentukan kandungan KOH dalam 500 mL larutannya, sebanyak 10 mL larutan KOH tersebut dititrasi dengan HCl 0,115 M. Ternyata HCl yang dibutuhkan adalah 18,72 mL. Maka jumlah mol KOH yang terdapat dalam 500 mL larutan KOH adalah ….
A. 0,00215 mol
B. 0,0043 mol
C. 0,108 mol
D. 0,215 mol
E. 0,125 mol
Jawaban: C
Soal No. 7
Untuk titrasi H3PO4 dengan larutan NaOH dipakai indikator fenolftalein (HPh). HPh tidak berwarna sedangkan Ph– berwarna merah. Bila terus menerus ditambahkan OH– maka indikator akan berubah warna…
A. Sebelum H2PO4– terbentuk
B. Setelah H3PO4 berubah menjadi H2PO4–
C. Setelah H2PO4– berubah menjadi HPO42-
D. Setelah HPO42- berubah menjadi PO43-
E. Setelah 3 mol NaOH ditambahkan ke dalam 1 mol H3PO4
Jawaban: E
Soal No. 8
Data titrasi 10 mL H2SO4 dengan NaOH 0,1 M adalah sebagai berikut
| Larutan | 1 | 2 | 3 |
| Volume NaOH | 5,0 mL | 4,9 mL | 5,1 mL |
Besarnya konsentrasi H2SO4 yang bereaksi adalah ….
A. 0,005 M
B. 0,025 M
C. 0,05 M
D. 0,25 M
E. 2,5 M
Jawaban: B
Soal No. 9
Larutan p-nitrofenol yang konsentrasinya 1,00 x 10-3 M dititrasi dengan larutan NaOH yang konsentrasinya 1,00 x 10-3M. Bila nilai Ka dari p-nitrofenol adalahh 7,08 x 10-8 pada 250C, berapa pH pada titik ekivalen….
A. 8,92
B. 8,62
C. 7,15
D. 5,10
E. 10,20
Jawaban: E
Soal No. 10
Larutan asam asetat 0,1 M sebanyak 20 mL (Ka = 10-5M) dititrasi dengan larutan natrium hidroksida 0,1 M. Pada saat penetesan natrium hidroksida mencapai 15 mL, pH larutan adalah ….
A. 4,0
B. 4,5
C. 5,0
D. 5,5
E. 6,0
Jawaban: D