Soal No. 31
Reaksi-reaksi dibawah ini yang termasuk reaksi redoks adalah ….
A. AgCl + 2NH3 → Ag(NH3)2Cl
B. NaOH + CH3COOH → CH3COONa + H2O
C. AgNO3 + NaCl → AgCl + NaNO3
D. OH– + Al(OH)3 → AlO2– + 2H2O
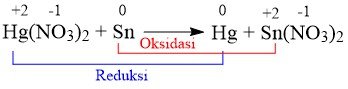
E. Hg(NO3)2 + Sn → Hg + Sn(NO3)2
Jawaban: E
Pembahasan:
Soal No. 32
Zat yang menjadi reduktor dan hasil reduksi pada reaksi berikut adalah ….
MnO2 + 2NaCl + 2H2SO4 → MnSO4 + Na2SO4 + 2H2O + Cl2
A. MnO2 dan MnSO4
B. NaCl dan Cl2
C. NaCl dan MnSO4
D. MnO2 dan NaCl
E. NaCl dan Na2SO4
Jawaban: B
Pembahasan:
Reduktor adalah zat yang mengalami pertambahan bilangan oksidasi dan menurunkan bilangan oksidasi zat lain.
Unsur Cl pada senyawa NaCl mempunyai biloks = -1
Unsur Cl pada senyawa Cl2 mempunyai biloks = 0
Itu artinya, unsur Cl mengalami pertambahan bilangan oksidasi, sehingga NaCl disebut sebagai reduktor dan Cl2 sebagai hasil reduksi.
Soal No. 33
Rumus kimia dari tembaga (I) oksida adalah ….
A. CuO
B. Cu2O
C. ZnO
D. TiO2
E. PbO
Jawaban: B
Soal No. 34
Nama dari senyawa Sn(SO4)2 adalah….
A. Seng (II) sulfat
B. Seng (IV) sulfat
C. Timah (II) sulfat
D. Timah (IV) sulfat
E. Timah (IV) sulfida
Jawaban: D
Soal No. 35
Pirolusit adalah nama lain dari mangan (IV) oksida dengan rumus kimia ….
A. MnO
B. MnO2
C. Mn2O
D. Mn2O3
E. MnO4
Jawaban: B
Soal No. 36
Berikut ini yang bukan syarat untuk terjadinya reaksi oksidasi adalah ….
A. Meningkatnya bilangan oksidasi
B. Pelepasan elektron
C. Pengikatan oksigen
D. Bertambahnya bilangan oksidasi
E. Penerimaaan elektron
Jawaban: E
Soal No. 37
Salah satu contoh dari reaksi reduksi adalah ….
A. Pemanasan
B. Karat besi
C. Fotosintesis
D. Pembakaran
E. Perubahan warna cokelat pada irisan buah apel ketika dibiarkan di udara
Jawaban: E
Soal No. 38
Logam yang bilangan oksidasinya +6 terdapat pada ion ….
A. MnO4–
B. VCl3
C. CrO42-
D. Fe(CN)42-
E. NH4+
Jawaban: C
Pembahasan:
A. MnO4–
MnO4– = biloks Mn + 4biloks O
-1 = Mn + (4 x (-2))
-1 = Mn – 8
Mn = +7
B. VCl3
VCl3 = biloks V + 3biloks Cl
0 = V + (3 x (-1))
0 = V – 3
V = +3
C. CrO42-
CrO42- = biloks Cr + 4biloks O
-2 = Cr + (4 x (-2))
-2 = Cr – 8
Cr = +6
D. Fe(CN)42-
Fe(CN)42- = Biloks Fe + 4 Biloks CN–
-2 = Fe + (4 x (-1))
-2 = Fe – 4
Fe = +2
E. NH4+
NH4+ = biloks N + 4 biloks H
1 = N + (4 x 1)
N = -3
Soal No. 39
Vanadium dengan bilangan oksidasi +2 terdapat pada senyawa ….
A. VCl3
B. VOSO4
C. K4V(CN)4
D. VCO3
E. VO2
Jawaban: D
Pembahasan:
A. VCl3
VCl3 = biloks V + 3biloks Cl
0 = V + (3 x (-1))
0 = V – 3
V = +3
B. VOSO4
VOSO4 = biloks V + 5 biloks O + biloks S
0 = V + (5 x (-2)) + 6
0 = V – 10 + 6
V = +4
C. K4V(CN)4
K4V(CN)4 = 4biloks K + biloks V + 4 biloks CN
0 = (4 x 1) + V + 4 (-1)
0 = 4 + V – 4
V = 0
D. VCO3
VCO3 = biloks V + biloks CO3
0 = V – 2
V = +2
E. VO2
VO2 = biloks V + 2biloks O
0 = V + (2 x (-2))
0 = V – 4
V = +4
Soal No. 40
Perhatikan reaksi berikut:
H2(g) + Cl2(g) → 2HCl(g)
Reaksi redoks tersebut dapat berlangsung. Pada reaksi tersebut yang berperan sebagai oksidator adalah ….
A. HCl
B. Cl2
C. Cl2 dan H2
D. H2
E. Cl2 dan HCl
Jawaban: B
Pembahasan:
Oksidator adalah zat yang mengalami penurunan biloks.
Biloks H pada H2 = 0
Biloks H pada HCl = +1
Jadi, H2 berperan sebagai reduktor dan HCl sebagai hasil reduksi dan oksidasi.
Biloks Cl pada Cl2 = 0
Biloks Cl pada HCl = -1
Jadi, Cl2 berperan sebagai oksidator dan HCl sebagai hasil reduksi dan oksidasi.
Soal No. 41
Pada reaksi:
MnO2(s) + 2H2SO4(aq) + 2NaI(aq) → MnSO4(aq) + Na2SO4(aq) + 2H2O(l) + I2(s)
yang berperan sebagai reduktor adalah …
A. MnSO4
B. MnO2
C. H2SO4
D. NaI
E. I2
Jawaban: D
Pembahasan:
Reduktor adalah zat yang mengalami pertambahan biloks.
Biloks Mn dalam MnO2 = +4
Biloks Mn dalam MnSO4 = +2
Jadi, MnO2 berperan sebagai oksidator dan MnSO4 sebagai hasil reduksi.
Biloks I dalam NaI = -1
Biloks I dalam I2 = 0
Jadi, NaI berperan sebagai reduktor dan I2 sebagai hasil oksidasi.
Soal No. 42
Nama senyawa dari Ba(OH)2 adalah ….
A. Barium hidrida
B. Natrium hidroksida
C. Barium hidrat
D. Barium hidroksida
E. Barium dihidroksida
Jawaban: D
Soal No. 43
Zat yang mengalami proses oksidasi disebut….
A. Reduktor
B. Oksidator
C. Katalisator
D. Inhibitor
E. Isolator
Jawaban: A
Soal No. 44
Perubahan bilangan oksidasi Pb dalam PbO2 dan PbSO4 berturut-turut yaitu ….
A. +4 dan +6
B. +6 dan +4
C. +4 dan +2
D. +2 dan +4
E. +6 dan +6
Jawaban: C
Pembahasan:
PbO2 = biloks Pb + 2biloks O
0 = Pb + (2 x (-2))
0 = Pb – 4
Pb = +4
Jadi, biloks Pb dalam PbO2 adalah +4
PbSO4 = biloks Pb + biloks S + 4biloks O
0 = Pb + 6 + (4 x (-2))
0 = Pb + 6 – 8
0 = Pb – 2
Pb = +2
Jadi, biloks Pb dalam PbSO4 adalah +2
Soal No. 45
Di antara zat berikut yang memiliki bilangan oksidasi nol, kecuali ….
A. C2H6 dan CH3Cl
B. O2 dan Cl2
C. Br2 dan Al3+
D. CH3Cl dan Br2
E. H2 dan Cl2
Jawaban: C
Pembahasan:
Biloks Br2 = 0
Biloks Al3+ = +3
Soal No. 46
Di antara unsur berikut yang tidak memiliki bilangan oksidasi +1 yaitu ….
A. H dalam senyawa hibrida
B. O dalam peroksida
C. Cl dalam HCl
D. O dalam superoksida
E. H dalam H2O
Jawaban: C
Pembahasan:
Biloks Cl dalam senyawa HCl adalah -1.
Soal No. 47
Reaksi oksidasi ditunjukkan oleh ….
A. I2 + 2e– → 2I–
B. Fe → Fe2+ + 2e–
C. Cu2+ + 2e– → Cu
D. 2H+ + O2- → H2O
E. Zn + e– → Zn2+
Jawaban: B
Pembahasan:
Oksidasi adalah reaksi pelepasan elektron. Sedangkan reduksi adalah reaksi penerimaan elektron.
Soal No. 48
Berikut merupakan pasangan yang benar tentang senyawa dan nama senyawa, kecuali ….
A. PbO2 : Timbal (IV) oksida
B. SnCl2 : Timah (II) klorida
C. Al2S3 : Aluminium (III) sulfida
D. FeO : Besi (II) oksida
E. Fe2O3 : Besi (III) oksida
Jawaban: C
Soal No. 49
Bilangan oksidasi +3 dimiliki oleh Cl dalam ….
A. Asam hipoklorit
B. Asam klorit
C. Asam klorat
D. Asam perklorat
E. Asam klorida
Jawaban: B
Pembahasan:
A. Asam hipoklorit (HClO)
HClO = biloks H + biloks Cl + biloks O
0 = 1 + Cl + (-2)
0 = 1 + Cl – 2
Cl = +1
B. Asam klorit (HClO2)
HClO2 = biloks H + biloks Cl + 2 biloks O
0 = 1 + Cl + (2 x (-2))
0 = 1 + Cl – 4
Cl = +3
C. Asam klorat (HClO3)
HClO3 = biloks H + biloks Cl + 3 biloks O
0 = 1 + Cl + (3 x (-2))
0 = 1 + Cl – 6
Cl = +5
D. Asam perklorat (HClO4)
HClO4 = biloks H + biloks Cl + 4biloks O
0 = 1 + Cl + (4 x (-2))
0 = 1 + Cl – 8
Cl = +7
E. Asam klorida (HCl)
HCl = biloks H + biloks Cl
0 = 1 + Cl
Cl = -1
Soal No. 50
Reaksi dalam pengolahan biji besi:
- 2C + O2 → 2CO
- Fe2O3 + 3CO → 2Fe + 3CO2
Zat yang mengalami reaksi reduksi adalah ….
A. Fe2O3 dalam reaksi 2
B. C dalam reaksi 1
C. CO dalam reaksi 2
D. CO dalam reaksi 1
E. O2 dalam reaksi 1
Jawaban: A
Pembahasan:
Biloks Fe dalam Fe2O3 = +3
Fe2O3 = 2 biloks Fe + 3 biloks O
0 = 2Fe + (3 x (-2))
0 = 2Fe – 6
Fe = 6/2 = +3
Biloks Fe dalam 2 Fe = 0
Soal No. 51
Jika bilangan oksidasi Fe = 3+ dan S = -2, maka bila kedua unsur tersebut bersenyawa akan membentuk senyawa dengan rumus kimia ….
A. Fe2S3
B. Fe3S2
C. Fe3S
D. FeS2
E. Fes
Jawaban: A