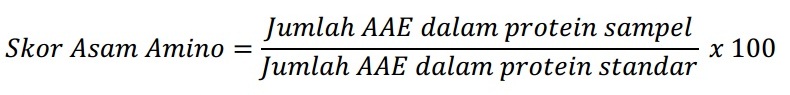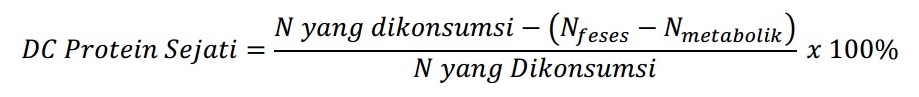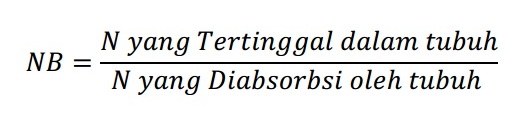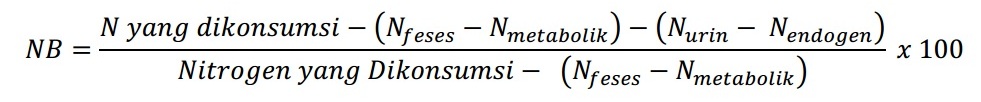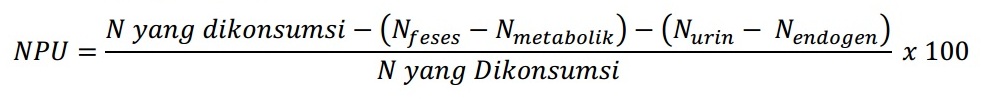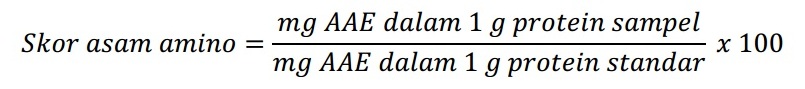Pengukuran mutu protein secara kuantitatif dapat dilakukan dengan beberapa cara berikut.
1. Profil Asam Amino
Salah satu cara menghitung mutu protein dapat dilakukan dengan menentukan profil asam amino esensial (AAE). Penentuan profil asam amino esensial dapat dilakukan menggunakan metode kromatografi antara lain menggunakan Kromatografi Cair Kinerja Tinggi (KCKT/HPLC) atau Penganalisis Asam Amino (Amino Acid Analyzer).
Pangan yang mengandung protein bermutu tinggi dinilai berdasarkan kelengkapan komposisi dan jumlah asam amino esensial dibandingkan dengan protein standar.
2. Skor Kimia
Metode ini didasari oleh nilai biologis suatu protein dibatasi dengan proporsi relatif asam amino esensial yang terkandung di dalamnya. Metode ini dikembangkan oleh Block dan Mictchell (1946-1947) dengan cara membandingkan setiap asam amino yang terkandung dalam protein tersebut dengan yang terkandung dalam protein telur sebagai protein standar. Kemudian nilai mutu protein dinyatakan oleh asam amino esensial yang paling defisien dibandingkan dengan telur utuh.
Metode ini dapat digunakan untuk menentukan skor asam amino baik untuk protein tunggal maupun produk campuran. Namun, daya cerna protein yang merupakan aspek penting dalam penentuan kualitas protein tidak diperhitungkan.
Selain itu, metode ini juga bergantung pada teknik analisis asam amino serta tidak mempertimbangkan keberadaan komposisi lain yang dapat mempengaruhi pencernaan dan utilisasi protein.
Metode skor kimia kemudian disederhanakan oleh McLaughlan dkk. (195) karena asam amino pembatas (limiting AA) dalam sebagian besar pangan adalah lisin, metionin (metionin + sistin), dan terkadang triptofan.
Sehingga perhitungan skor kimia hanya dilakukan terhadap asam-asam amino tersebut. Dalam metode ini ini, skor setiap asam amino esensial dinyatakan sebagai persentase konsentrasi yang dinyatakan sebagai persentase konsentrasi yang terdapat dalam telur utuh (sebagai protein referensi dengan nilai 100), perhitungannya sebagai berikut:
Skor kimia dinyatakan oleh angka skor asam amino yang terendah. Dalam hal ini, apabila metionin merupakan asam amino esensial yang paling defisien, maka hanya kadar metionin saja yang digunakan dalam perhitungan skor.
3. Lisi Tersedia (Available Lysine)
Dalam pengolahan pangan, asam amino dalam protein biasanya bereaksi dengan senyawa lain contohnya dengan gula pereduksi dalam reaksi Maillard. Salah satu asam amino yang paling mudah bereaksi adalah lisin karena mengandung grup amino “bebas” yaitu epsilon-amino yang dapat berikatan dengan senyawa-senyawa lain.
Selain itu, analisis lisin penting mengingat beberapa produk pangan seperti serealia kekurangan jenis asam amino ini. Reaksi lisin dengan senyawa lain dapat mengakibatkan lisin tersebut tidak dapat dicerna, diserap dan digunakan oleh tubuh, sedangkan lisin merupakan salah satu asam amino esensial dan sering kali merupakan asam amino pembatas dalam protein nabati terutama serealia.
Ketidaktersediaan lisin mempengaruhi mutu protein suatu pangan. Terdapat 3 metode untuk penetapan kadar lisin, yaitu metode FDNB, metode TNBS1, dan metode TNBS2.
a. Metode FDNB
1. Prinsip
Dalam metode ini, protein sampel direaksikan dengan 1-fluoro-2,2-dinitrobenzen (FDNB). Protein yang telah dinitrofenilasi tersebut, kemudian dihidrolisis dengan asam dan senyawa-senyawa yang tidak reaktif dipisahkan dari turunan dinitrofenil dengan cara ekstraski menggunakan dietil eter.
Turunan-turunan DNP berwarna yang paling banyak terdapat dalam hidrolisat protein tersebut adalah epsilon-DNP-lisin, alfa-DNP-arginin, delta-DNP-ornitin, dan epsilon-DNP-hidroksilisin.
Densitas optik total campuran turunan-turunan tersebut adalah seperti yang ditunjukkan oleh larutan dalam tabung A. Penambahan metil kloroformiat dan asam klorida, diikuti oleh ekstraksi menggunakan dietil eter akan memisahkan epsilon-DNP-lisin dari senyawa-senyawa DNP lainnya yang akan tersebar dalam fase cair larutan dalam tabung B.
Perbedaan densitas optik pada panjang gelombang 435 nm antara larutan A dan B adalah densitas optik epsilon-DNP-lisin. Angka ini selanjutnya dibandingkan dengan densitas optik larutan standar epsilon-DNP-lisin-HCl.
2. Pereaksi
- Larutan NaHCO3 8%
- Larutan FDNB (sigma atau fluka), 2,5% dalam ethanol.
- Larutan HCl 1 N; 8, 1 N; dan 12 N.
- Larutan NaOH 2,5 N
- Dietil eter.
- Fenolftalein 40 mg/mL dalam ethanol 60%
- Larutan Na2CO3 1 M; pH 8,5
- Larutan metil kloroformiat 97% (sigma atau fluka)
- Larutan epsilon-DNP-lisin-HCl (sigma) 0,12% dalam HCl 8,1 N
3. Prosedur
- Lebih kurang 1 g sampel disuspensikan dalam 10 mL larutan NaHCO3 8%, kemudian ke dalamnya ditambahkan 15 mL larutan FDNB 2,5%. Campuran ini diaduk selama 2 jam pada suhu ruang.
- Ethanol dalam campuran tersebut diuapkan dengan cara menempatkan campuran dalam penangas air 100°C. Kemudian 30 mL HCl 8,1 N ditambahkan pada residu. Selanjutnya hidrolisis asam terhadap protein dilakukan di bawah refluks selama 16 jam.
- Larutan hidrolisat kemudian disaring dengan kertas saring Whatman nomor 1 dan volume filtrat yang diperoleh ditempatkan menjadi 250 mL dengan air destilata.
- Sebanyak 2 mL filtrat dan 2 mL dietil eter dimasukkan ke dalam tabung reaksi A dan B yang masing-masing telah diberi tanda tera 10 mL. Ekstraksi dilakukan dengan cara mengocok tabung secara hati-hati.
- Setelah ekstraksi, fase eter dihilangkan dengan cara dekantasi dan residu eter dihilangkan dengan cara penguapan, yaitu merendam tabung dalam penangas air 100°C. Ekstraksi dengan dietil eter diulangi lagi sebanyak dua kali.
- Setelah ekstraksi sebanyak tiga kali, volume tabung A ditempatkan menjadi 10 mL dengan penambahan HCl 1 N. Kemudian densitas optiknya diukur dengan spektrofotometer pada panjang gelombang 435 nm.
- Kemudian ditambahkan satu tetes fenolftalein ke dalam tabung B, kemudian NaOH tetes demi tetes hingga timbul warna merah. Setelah itu, ditambahkan 2 mL larutan Na2CO3 1M; pH 8,5; dan 50 μL mtil kloroformiat. Campuran segera diaduk secara perlahan (dalam ruang asam, metil kloroformiat bersifat iritan terhadap mata).
- Setelah 10 menit, tambahkan, 0,75 mL HCl 12 N, kemudian campuran diekstrasi tiga kali dengan 5 mL dietil eter. Selanjutnya volume tabung B ditempatkan mejadi 10 mL dengan menambahkan akuades. Kemudian densitas optiknya diukur pada panjang gelombang 435 nm.
- Perbedaan densitas optik larutan A dan B adalah densitas optik epsilon-DNP-lisin. Nilai ini dibandingkan dengan densitas optik larutan standar epsilon-DNP-lisin-HCl dalam HCl 8,1 N. Kadar lisin tersedia dihitung dalam satuan g/100 g protein (berat kering).
b. Metode (TNBS)1
1. Prinsip
Protein sampel direaksikan dengan trinitrobenzensulfonat (TNBS). Protein yang telah mengalami trinitrofenilasi tersebut kemudian dihidrolisis dengan asam. Selanjutnya senyawa-senyawa lain epsilon-trinitrofenil-lisin dipisahkan dengan cara ekstraksi menggunakan etil eter.
Kemudian densitas optik larutan diukur menggunakan spektrofotometer pada panjang gelombang 346 nm. Kadar lisin tersedia (epsilon-TNP-lisin) dihitung dengan menggunakan nilai absorptivitas molar sebesar 1,46 x 104 M-1cm-1.
2. Pereaksi
- Larutan NaHCO3 4%; pH 8,5.
- Larutan trinitrobenzensulfonat (TNBS) 1% (dalam akuades).
- Larutan HCl pekat
- Etil eter
3. Prosedur
- Sebanyak 10 mg sampel protein yang telah ditepungkan dimasukkan ke dalam tabung reaksi bertutup, kemudian ditambahkan ke dalamnya 1 mL larutan NaHCO3 4%. Suspensi ditempatkan dalam penangas air bergoyang (shaker) pada suhu 40ºC selama 10 menit.
- Kemudian ditambahkan ke dalamnya 1 mL larutan TNBS 1%. Reaksi dibiarkan berlangsung selama 2 jam pada suhu 40°C dan kemudian ditambahkan 3 mL HCl pekat.
- Tabung reaksi ditutup rapat, kemudian dipanaskan dalam otoklaf pada suhu 120°C selama 1 jam.
- Didinginkan hingga mencapai suhu ruang, kemudian disaring dan dicuci lima kali dengan 1 mL akuades.
- Filtrat yang diperoleh kemudian diekstrak dengan 10 mL etil eter. Fase eter dipisahkan dengan cara dekantasi dan residu eter dihilangkan dengan cara meletakkan tabung dalam air mendidih selama 5 menit. Ekstraksi dilakukan sebanyak tiga kali.
- Kemudian fase air diukur densitas optiknya menggunakan spektrofotometer pada panjang gelombang 345 nm dengan suatu banko yang diperlakukan sama dengan prosedur di atas, kecuali penambahan HCl pekat ke dalam larutan protein dilakukan sebelum penambahan TNBS. Banko juga dapat dibuat seperti di atas naman tanpa ada protein.
- Kadar lisin tersedia (epsilon-TNP-lisin) dihitung dengan menggunakan absorptivitas molar sebesar 1,46 x 104 M-1cm-1.
c. Metode (TNBS)2
1. Prinsip
Sampel protein direaksikan dengan pereaksi TNBS (trinitrobenzensulfonat) seperti halnya pada metode TNBS1 sehingga prinsipnya sama, kecuali bahwa metode ini hanya dapat digunakan untuk protein yang bersifat larut dalam air.
2. Pereaksi
- Larutan NaHCO3 0,47 M.
- Larutan TNBS 34 nM (dalam akuades)
- Larutan HCl pekat
- Etil eter
- Larutan standar epsilon-TNP-lisin
3. Prosedur
- Larutan protein 0,5 mL (90 mg dalam 15 mL larutan NaHCO3 0,47 M) dalam tabung dihidrolisis vakum ditambahkan 0,5 mL pereaksi TNBS 3 mM dan campuran diinkubasikan selama 2 jam pada suhu 40°C.
- Selanjutnya ditambahkan 1,5 mL HCl pekat, kemudian tabung divakumkan dan ditutup. Selanjutnya dihidrolisis asam terhadap protein dilakukan pada suhu 110ºC selama 90 metil dalam autoklat atau panci bertekanan.
- Setelah didinginkan, hidrolisat diencerkan menjadi 25 mL dengan menambahkan akuades. Sebanayk 5 mL alikuot hidrolisat diekstraksi sebanyak empat kali dengan 5 mL etil eter (dilakukan seperti pada metode TNBS1)
- Densitas optik fase air diukur pada panjang gelombang 346 nm menggunakan banko seperti pada metode TNBS1
- Kadar lisin tersedia (epsilon-TNP-lisin) dihitung berdasarkan kurva standar yang dibuat dari densitas optik berbagai konsentrasi larutan epsilon-TNP-lisin.
4. Protein Efficiency Ratio (PER)
PER merupakan perbandingan antara pertambahan berat badan tikus dengan jumlah protein yang dikonsumsi tikus. Perhitungan PER digunakan untuk menghitung efisiensi suatu protein pangan dalam sintesis protein di dalam tubuh.
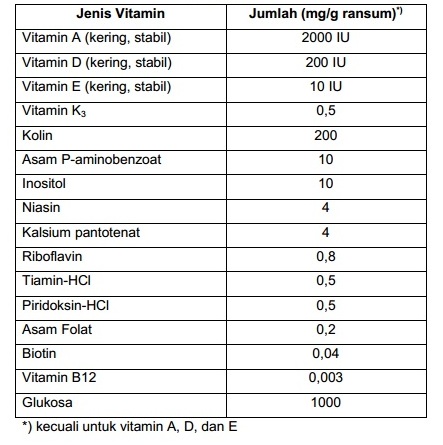
PER merupakan metode evaluai mutu protein yang paling banyak digunakan dan sudah diterima sebagai metode resmi untuk menilai mutu protein dalam pelabelan gizi oleh Food and Drug Administration (FDA). Komposisi ransum yang digunakan dan komposisi campuran vitamin adalah sebagai berikut.
Tabel Komposisi Ransum yang Dianjurkan untuk Penetapan PER
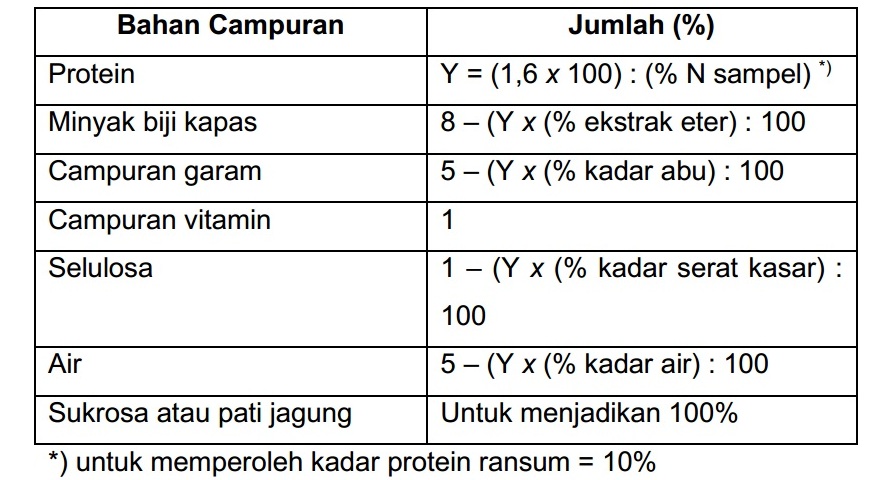
Tabel Komposisi Campuran Vitamin untuk Penetapan PER menurut AOAC
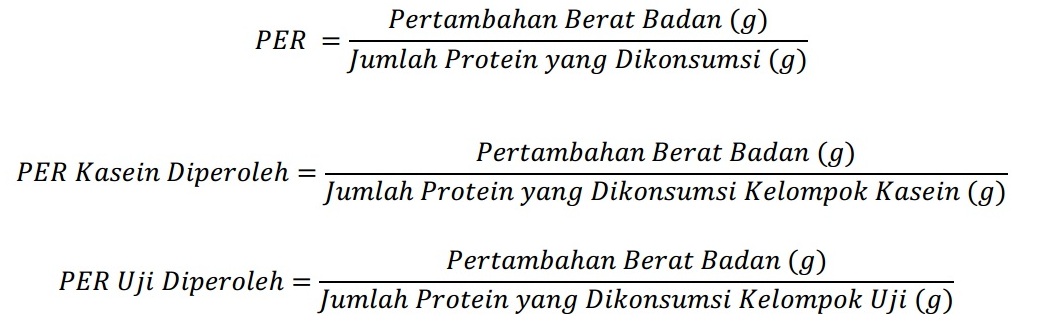
Perhitungan PER dilakukan dengan menggunakan rumus:
Perhitungan harus dilakukan untuk setiap sampel, dimana nilai rata-rata dihitung untuk setiap kelompok. Apabila digunakan kasein selain kasein ANRC, maka nilai PER yang diperoleh dari percobaan distandarisasi sebagai berikut.
Data PER sampel dapat distandarisasi dengan cara lain, yaitu dihitung sebagai persentase dari PER kasein. Persentase dari nilai PER kasein bukan merupakan persentase dari nilai gizi kasein karena PER bukan merupakan fungsi linier. Faktor yang paling berpengaruh terhadap nilai PER adalah kadar protein ransum sehingga dibuat standarisasi untuk kadar protein ransum adalah 10%.
5. Daya Cerna Protein Sejati (True Protein Digestibility)
Daya cerna protein sejati ditentukan berdasarkan dua studi keseimbangan nitrogen. Namun, daya cerna protein sejati hanya melihat jumlah nitrogen yang dikonsumsi, jumlah nitrogen feses, dan dikoreksi dengan jumlah nitrogen feses kelompok yang tidak diberikan protein.
Daya cerna protein sejati atau true protein digestibility merupakan perbaikan dari kecernaan protein semu apparent digestibility of protein). Kecernaan semu tidak memperhitungkan jumlah nitrogen yang dieksresikan dalam feses yang bukan berasal dari protein diet.
Oleh karena itu, kecernaan protein semu akan meningkat seiring dengan meningkatnya asupan protein, namun tidak dengan daya cerna protein sejati yang relatif konstan meskipun jumlah protein yang dikonsumsi ditingkatkan.
Hal ini membuat daya cerna protein sejati lebih disarankan dalam menilai kualitas protein dibandingkan kecernaan protein semu. Daya cerna protein sejati ditentukan secara biologis menggunakan tikus percobaan. Daya cerna protein sejati dihitung menggunakan rumus.
6. Nilai Biologis (NB)
Nilai biologis merupakan salah satu cara mengetahui kualitas protein yang dibandingkan dengan kebutuhan tubuh. Nilai biologis didapatkan dari perbandingan jumlah nitrogen yang dipertahankan tubuh dengan jumlah nitrogen yang diserap tubuh.
Artinya, metode ini menggambarkan seberapa cocok asam amino yang diserap tubuh dapat memenuhi kebutuhan tubuh. Metode ini melibatkan dua penelitian keseimbangan nitrogen. Studi pertama adalah studi tanpa memberikan protein dalam diet hewan coba. Hal ini diperlukan untuk melihat jumlah nitrogen dikeluarkan tubuh melalui feses dan urin yang bukan berasal dari asupan protein.
Sedangkan studi kedua yaitu studi dengan memberikan protein uji pada hewan coba. Metode ini juga dapat dilakukan pada manusia. Adapun kelemahan metode ini yaitu butuh banyak tenaga untuk melakukannya dan relatif lebih mahal.
Selain itu, jumlah nitrogen yang dipertahankan tubuh belum tentu dapat diutilisasi dengan baik serta perbedaan tipe pangan yang dikonsumsi antara pada proses pengujian dengan yang biasa dikonsumsi dapat saja berbeda sehingga juga dapat mempengaruhi kualitas protein. Berikut rumus perhitungan nilai biologis.
Rumus tersebut kemudian diadopsi oleh Mitchell (1923-1924) karena rumus tersebut memerlukan ketelitian dalam pengumpulan dan pengukuran pangan yang dikonsumsi serta ekskreta (feses dan urine) sehingga sangat sulit dilakukan. Rumus adopsi tersebut adalah.
7. Net Protein Utilization (NPU) Hitung
Net Protein Utilization (NPU) merupakan metode yang hampir sama dengan nilai biologis. Perbedaan hanya pada pembagian dimana pada metode ini jumlah dikonsumsi sebagai pembanding. Artinya, metode ini menggambarkan bagaimana protein yang dikonsumsi dapat dipertahankan oleh tubuh.
NPU sering digunakan oleh industri peternakan dalam menentukan jenis pakan untuk meningkatkan berat daging namun harga relatif lebih murah.
NPU merupakan perbandingan antara jumlah nitrogen yang direntensi dalam tubuh dengan jumlah nitrogen yang dikonsumsi, sehingga dapat dihitung sebagai hasil perkalian antara Nilai Biologis dan Daya Cerna Sejati dengan rumus.
8. Protein Digestibility – Corrected Amino Acid Score (PDCAAS)
Metode yang menggambarkan daya cerna protein sejati yang ditetapkan secara biologis dengan skor asam amino esensial dengan nilai terendah (skor kimia). Prosedur untuk menghitung PDCAAS adalah sebagai berikut.
1. Penetapan Kadar Protein
Pentapan kadar protein sampel dilaksanakan dengan menggunakan metode Kjeldahl, kemudian dihitung kadar protein sampel dengan cara mengalikan kadar total nitrogen dengan faktor konversi.
2. Analisis Asam Amino
Profil asam amino esensial sampel dalam satuan mg/g protein diperoleh dari hasil analisis asam amino.
3. Perhitungan Skor Asam Amino
Skor asam amino esensial dihitung dengan rumus.
4. Penetapan Daya Cerna Protein
Daya cerna protein sejati ditentukan secara biologis menggunakan hewan percobaan (tikus). Daya cerna protein sejati dihitung dengan menggunakan rumus.
5. Perhitungan PDCAAS
PDCAAS dapat dihitung dengan menggunakan rumus.
PDCAAS = Skor AAE Terendah x DC Protein Sejati
9. The Digestible Indispensable Amino Acid Score (DIAAS)
Digestible indispensable amino acid score (DIAAS) merupakan teknik penilaian mutu protein yang relatif baru. FAO/WHO pada tahun 2013 mengusulkan DIAAS sebagai metode penilaian kualitas protein menggantikan PDCAAS.
Hal ini disebabkan oleh penetapan PDCAAS tidak memberikan nilai lebih pada protein dengan kualitas tinggi, kurang mempertimbangkan pada produk yang mengandung zat anti gizi, tidak mempertimbangkan bioavailabilitas asam amino, serta kurang mempertimbangkan pada protein yang daya cernanya rendah namun disuplementasi dengan asam amino pembatasnya.
DIAAS didapat dengan membandingkan jumlah asam amino yang dicerna dengan kebutuhan. DIAAS tidak memandang kualitas protein hanya sebatas daya cerna protein saja melainkan ditentukan oleh daya cerna asam amino.
Prosedur penetapan DIAAS menurut FAO 2013 sebagai berikut.
- Kadar asam amiino ditetapkan dengan AOAC 2005
- Kadar asam amino protein dikalikan dengan koefisien daya cerna asam amino sejati untuk mengestimasi jumlah asam amino yang dicerna. Metode penetapan daya cerna asam amino sejati juga dapat dilakukan secara langsung dengan merujuk pada bagian prosedur daya cerna protein sejati.
- Jumlah asam amino yang dicerna kemudian dibandingkan dengan pola kebutuhan asam amino sesuai kategori umur.
- Skor DIAAS ditetapkan berdasarkan skor terendah.
Rumus untuk menghitung persentase PDCAAS adalah sebagai berikut.