Laju reaksi adalah perubahan konsentrasi pereaksi (reaktan) atau konsentrasi hasil reaksi (produk) tiap satuan waktu.
A. Faktor-Faktor yang Mempengaruhi Laju Reaksi
Ada 4 faktor yang mempengaruhi laju reaksi yaitu luas permukaan bidang sentuh, konsentrasi, suhu dan katalis.
1. Luas Permukaan Bidang Sentuh
Semakin luas permukaan bidang sentuh zat yang bereaksi akan mempermudah terjadinya tumbukan efektif yang menyebabkan terjadinya reaksi kimia sehingga mempercepat laju reaksi.
Luas permukaan bidang sentuh bisa dilakukan dengan cara memperkecil ukuran zat. Reaksi kimia yang menggunakan pereaksi dalam bentuk serbuk akan menghasilkan lau reaksi yang lebih cepat dibandingkan dalam bentuk kepingan jika direaksikan dengan larutan yang konsentrasinya sama.
2. Konsentrasi
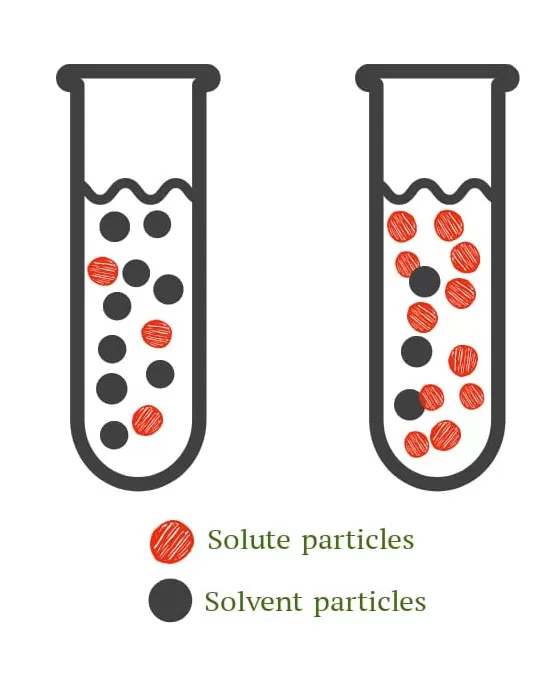
Jika konsentrasi pereaksi bertambah, maka jumlah partikel pereaksi akan semakin banyak. Bertambahnya jumlah partikel pereaksi akan semakin mudah terjadi tumbukan antar partikel pereaksi sehingga kemungkinan terjadinya reaksi semakin besar. Hal inilah yang menyebabkan jika konsentrasi pereaksi semakin besar menyebabkan laju reaksi semakin cepat.
3. Suhu

Kenaikan suhu mempercepat laju reaksi karena kenaikan suhu menyebabkan gerakan partikel semakin cepat. Gerakan ini menyebabkan energi kinetik partikel-partikel bertambah sehingga makin banyak kemungkinan terjadinya tumbukan yang efektif. Dengan demikian makin banyak partikel-partikel yang bereaksi.
4. Katalis
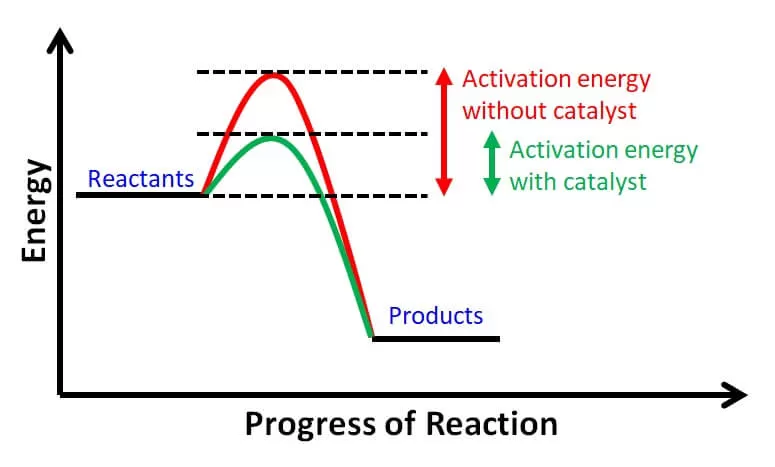
Pada umumnya katalis dapat meningkatkan laju reaksi, tanpa mengalami perubahan kimia yang tetap dan akan terbentuk kembali pada akhir reaksi. Katalis yang dapat mempercepat laju reaksi disebut katalis positif atau dikenal dengan nama katalisator.
Sedangkan katalis yang memperlambat laju reaksi disebut katalis negatif atau dikenal dengan nama inhibitor.
Peran katalis dalam pempercepat laju reaksi dengan cara membuat mekanisme reaksi alternatif (yang berbeda) dengan harga energi aktifasi (Ea) yang lebih rendah dengan energi aktifasi (Ea) tanpa katalis.
Dengan Ea yang lebih rendah menyebabkan lebih banyak partikel yang mengalami tumbukan efektif sehingga laju reaksi menjadi meningkat.
B. Teori Tumbukan
Teori tumbukan menggambarkan bahwa pertemuan partikel-partikel pereaksi akan menghasilkan produk apabila terjadi tumbukan yang efektif. Ada 2 faktor yang menyebabkan terjadinya tumbukan efektif yaitu energi kinetik partikel dan arah partikel.
1. Energi Kinetik Partikel
Pada proses tumbukan, partikel-partikel saling mendekat dan terjadi gaya tolak-menolak antar elektron terluar masing-masing partikel. Gaya tolak-menolak ini dapat diatasi apabila partikel memiliki energi kinetik yang cukup sehingga dapat terjadi tumbukan yang efektif.
2. Arah Partikel yang Bertumbukan
Suatu tumbukan efektif dapat terjadi jika partikel-partikel pereaksi juga mempunyai orientasi atau arah yang tepat pada saat bertumbukan.
C. Hukum Laju Reaksi
Pada reaksi:
aA + bB → cC + dD
Di mana A dan B adalah pereaksi, C dan D adalah produk dan a, b, c, dan d adalah koefisien penyetaraan reaksi, maka hukum laju reaksinya dapat dituliskan sebagai berikut:
Pangkat m dan n ditentukan dari data eksperimen, biasanya mempunyai harga yang kecil dan tidak selalu sama dengan koefisien a dan b. Semakin besar harga k, reaksi akan berlangsung lebih cepat. Kenaikan suhu dan penggunaan katalis umumnya memperbesar harga k. Secara formal hukum laju adalah persamaan laju reaksi yang menyatakan laju reaksi sebagai fungsi dari konsentrasi semua komponen spesies yang menentukan laju reaksi.
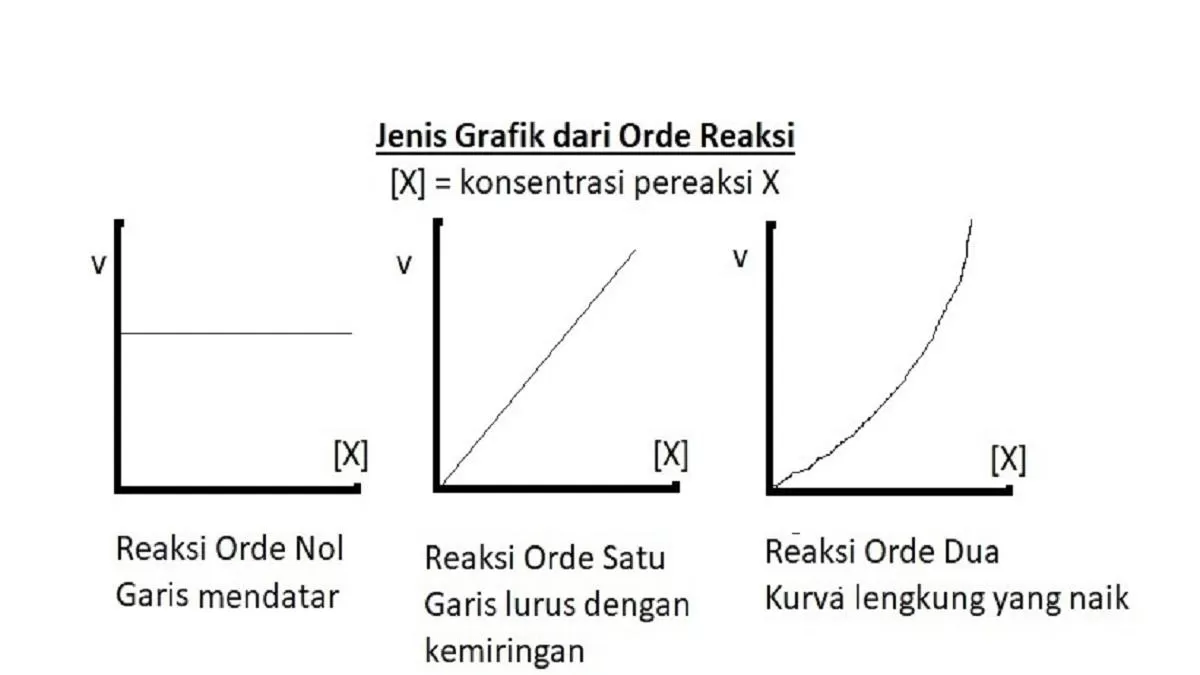
D. Orde Reaksi
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Secara garis besar, terdapat beberapa macam orde reaksi yaitu:
1. Orde 0 (nol)
Reaksi dikatakan berorde nol terhadap salah satu pereaksinya apabila perubahan konsentrasi pereaksi tersebut tidak mempengaruhi laju reaksi. Artinya, asalkan terdapat dalam jumlah tertentu, perubahan konsentrasi pereaksi itu tidak mempengaruhi laju reaksi.
2. Orde 1 (satu)
Suatu reaksi dikatakan berorde satu terhadap salah satu pereaksinya jika laju reaksi berbanding lurus dengan konsentrasi pereaksi itu. Misalkan, konsentrasi pereaksi itu dilipat tigakan maka laju reaksi akan menjadi 3¹ atau 3 kali lebih besar.
3. Orde 2 (dua)
Suatu reaksi dikatakan berorde dua terhadap salah satu pereaksi jika laju reaksi merupakan pangkat dua dari konsentrasi pereaksi itu. Apabila konsentrasi zat itu dilipat tigakan, maka laju reaksi akan menjadi 3² atau 9 kali lebih besar.
E. Penerapan Laju Reaksi
Penerapan laju reaksi banyak digunakan dalam proses industri seperti proses pembuatan amoniak sebagai bahan pembuatan pupuuk urea, bahan dasar pembuatan asam nitrat dan bahan peledak.
Proses pembuatan amoniak dikenal dengan nama proses Haber-Bosch. Disamping itu kita juga mengenal proses pembuatan asam sulfat yang dikenal dengan proses kontak.
F. Mengendalikan Laju Reaksi untuk Mencegah Kerusakan Bahan Pangan
Untuk menghambat laju reaksi pembusukan atau kerusakan pada bahan pangan dapat dilakukan dengan beberapa hal seperti berikut ini.
- Menyimpan bahan pangan pada suhu rendah, misalnya di lemari es atau kontainer berpendingin (cold storage). Kondisi suhu yang sangat rendah akan memperlambat reaksi pembusukan bahan makanan.
- Meyimpan bahan pangan pada ruang yang bebas oksigen. Oksigen merupakan oksidator terhadap bahan pangan. Konsentrasi oksigen yang rendah, atau bahkan bebas oksigen akan memperlambat laju reaksi oksidasi yang bersifat merusak.
- Penambahan bahan pengawet pada makanan berfungsi untuk menghambat kerja enzim yang dibutuhkan oleh bakteri atau jamur. Terhambatnya kerja enzim akan mengakibatkan bakteri tidak dapat berkembang biak dengan baik.
- Penambahan asam atau garam pada makanan menyebabkan enzim yang mempercepat laju reaksi perusakan bahan pangan tidak dapat bekerja optimum sehingga menghambat kerusakan bahan pangan.