Entalpi pembentukan standar (ΔH°f) adalah energi yang diterima atau dilepas untuk membentuk 1 mol zat dari unsur pembentuknya. Nilai entalpi pembentukan standar ditentukan menggunakan data entalpi pembentukan standar.
Nilai-nilai entalpi pembentukan standar.
- Bernilai positif, jika menerima energi
- Bernilai negatif, jika menerima energi
- Bernilai nol, jika unsur tersebut sudah terdapat di alam secara alami.
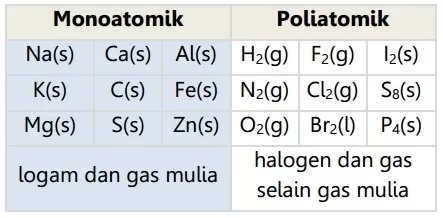
Bentuk unsur-unsur yang sudah terdapat alami di alam, dan nilai entalpi pembentukan standarnya nol:
Contoh:
1. Pada pembentukan (NH4)2Cr2O7 dalam keadaan standar, dibebaskan energi sebesar 2780,08 kJ/mol, tentukan persamaan reaksi pembentukan termokimia!
Jawaban:
N2(g) + 4H2(g) + 2Cr(s) + 7/2 O2(g) → (NH4)2Cr2O7(aq) ∆H0f = – 2780,08 kJ
2. Tulis persamaan pembentukan 2 mol air dengan membebaskan 136,6 kkal
Jawaban:
2H2(g) + O2(g) → 2H2O(l) ∆H0f = – 136,6 kkal
3. ∆H0f pembentuukan 1 mol H2O cair dari gas H2 dan O2 adalah – 285,9 kJ.mol-1. Persamaan termokimianya adalah ….
Jawaban:
H2(g) + ½ O2(g) → H2O(l) ∆H = – 285,9 kJ
4. Tuliskan persamaan termokimia untuk reaksi pembentukan NH4Cl bila diketahui ∆H0f NH4Cl = – 120 kJ/mol!
Jawaban:
½ N2(g) + 2H2(g) + ½ Cl2(g) → NH4Cl(s) ∆H0f = – 120 kJ/mol
5. Tuliskan persamaan termokimia pembentukan CaCO3 yang membebaskan kalor sebesar 224 kJ!
Jawaban:
Ca(s) + C(s) + 3/2 O2(g) → CaCO3(s) ∆H0f = – 200 kJ/mol
6. Pada pembentukan 22 gram C3H8 (Ar C = 12, H = 1) dibebaskan kalor sebesar 75 kJ. Tuliskan persamaan termokimia pembentukan C3H8!
Jawaban:
Jumlah mol C3H8 = gr/Mr
Jumlah mol C3H8 = 22/44 = 0,5 mol
∆H0f = – 75/0,5 = – 150 kJ
Persamaan termokimia pembentukan C3H8 adalah:
3C(s) + 4H2(g) → C3H8(s) ∆H0f = – 150 kJ/mol
7. Hitunglah besar kalor yang dibebaskan pada pembentukan 45 gram C6H12O6 (Mr = 180) bila ∆H0f C6H12O6= – 124 kJ/mol!
Jawaban:
Jumlah mol C6H12O6 = gr/Mr
Jumlah mol C6H12O6 = 45/180 = 0,25 mol
Besarnya kalor = 0,25 x (– 124) = – 31 kJ
Jadi, pada pembentukan 45 gram C6H12O6 dibebaskan kalor sebesar 31 kJ.