Perngertian termokimia adalah cabang ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi kimia atau proses fisika.
1. Energi dan Kalor
- Hukum kekekalan energi berbunyi: “energi tidak dapat diciptakan dan tidak dapat dimusnahkan. Namun energi dapat berubah bentuk menjadi energi lain.”
- Pengertian kalor adalah energi yang berpindah dari satu benda ke benda yang lain akibat adanya perubahan suhu
2. Entalpi dan Perubahan Entalpi (∆H)
Pengertian entalpi (H) adalah jumlah energi yang dimiliki sistem pada tekanan tetap. Rumus entalpi adalah sebagai berikut.
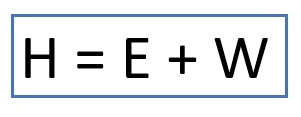
Keterangan:
H = Entalpi (joule)
E = Energi (joule)
W = Kerja sistem (joule)
Perubahan entalpi (∆H) adalah perubahan energi dari awal hingga akhir reaksi kimia. Rumus perubahan entalpi adalah sebagai berikut.
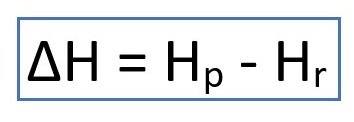
Keterangan:
∆H = Perubahan entalpi
Hp = Entalpi produk
Hr = Entalpi reaktan
- Jika ∆H bertanda positif, maka mengalami reaksi endoterm yaitu reaksi penyerapan kalor dari lingkungan ke sistem.
- Jika ∆H bertanda negatif, maka mengalami reaksi eksoterm yaitu reaksi yang membebaskan kalor dari sistem ke lingkungan.
3. Persamaan Termokimia
Persamaan termokimia adalah persamaan reaksi yang dilengkapi dengan perubahan entalpinya. Contoh persamaan termokimia.
Persamaan reaksi tersebut mempunyai arti bahwa 1 mol air dibentuk dari hidrogen dan oksigen dengan membebaskan energi sebesar 286 kJ.
4. Perubahan Entalpi Standar (∆H0)
Perubahan entalpi standar adalah perubahan entalpi yang terjadi pada suhu 250C dan tekanan 1 atm. Macam-macam perubahan entalpi standar adalah sebagai berikut:
- Entalpi pembentukan standar (∆Hf0), adalah energi yang diterima atau dilepas untuk membentuk 1 mol zat dari unsur pembentuknya.
- Entalpi penguraian standar (∆Hd0), adalah energi yang diterima atau dilepas untuk menguraikan 1 mol zat menjadi unsur pembentuknya.
- Entalpi pembakaran standar (∆Hc0), adalah energi yang yang dilepaskan untuk membakar 1 mol zat.
- Entalpi atomisasi standar, adalah energi yang digunakan untuk membentuk 1 mol atom.
- Entalpi netralisasi standar, adalah energi yang dihasilkan dari reaksi asam-basa sehingga menghasilkan 1 mol air.
- Entalpi peleburan standar, adalah energi yang digunakan untuk meleburkan 1 mol zat padat menjadi zat cair pada titik leburnya.
- Entalpi penguapan standar, adalah energi yang digunakan untuk menguapkan 1 mol zat cair menjjadi gas pada titik uapnya.
- Entalpi penyubliman standar, adalah energi yang digunakan untuk menyublimkan 1 mol zat padat menjadi gas.
5. Penentuan Perubahan Entalpi Reaksi
Penentuan perubahan entalpi reaksi dapat dilakukan dengan menggunakan 4 cara yaitu:
A. Menggunakan kalorimetri
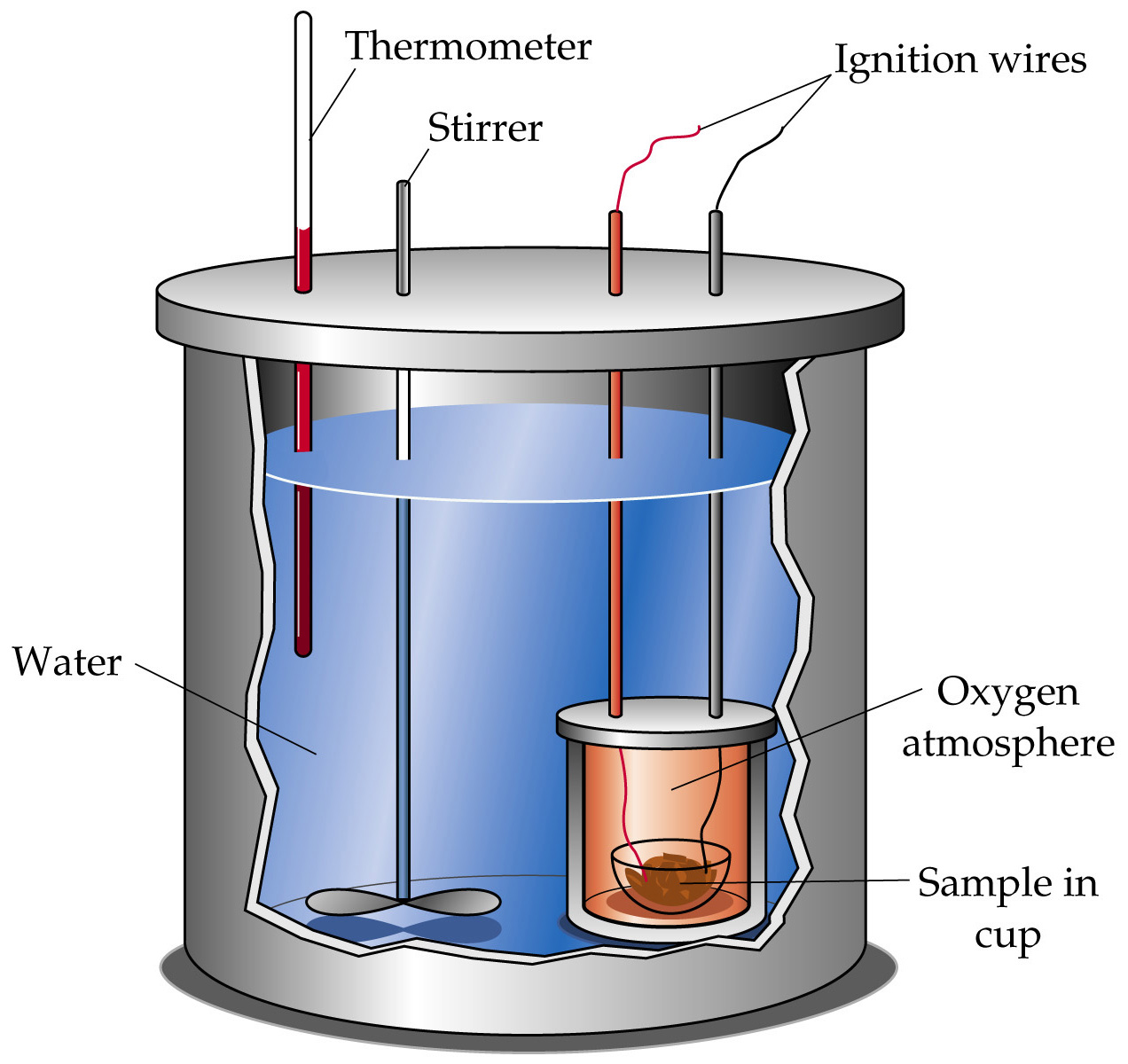
Kalorimetri adalah cara penentuan perubahan entalpi reaksi dengan kalorimeter.
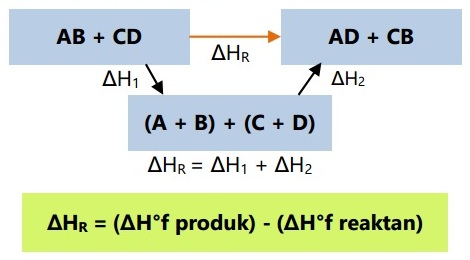
B. Menggunakan Hukum Hess
Menurut hukum hess, perubahan entalpi hanya tergantung pada keadaan awal dan akhir sistem, bukan tahap yang ditempuh dan merupakan penjumlahan entalpi reaksi dari setiap tahap.
C. Menggunakan data entalpi pembentukan
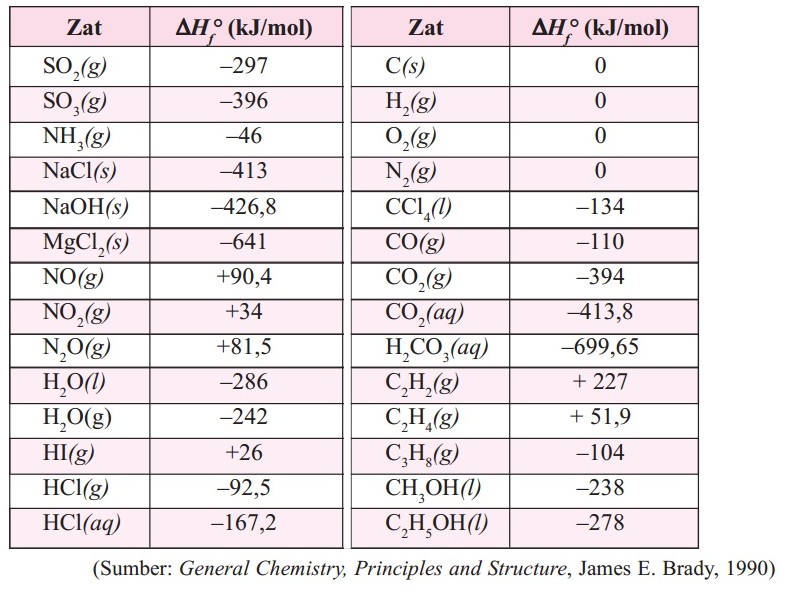
Dari konsep hukum hess, energi kalor suatu reaksi juga dapat ditentukan dari data entalpi pembentuk reaktan dan produknya. Bentuk reaksi umumnya digambarkan sebagai berikut:
Dari reaksi umum diatas dapat kita artikan bahwa zat reaktan terurai terlebih dahulu menjadi unsur-unsur penyusunnya, kemudian bereaksi kembali membentuk produk baru.
D. Menggunakan data energi ikatan
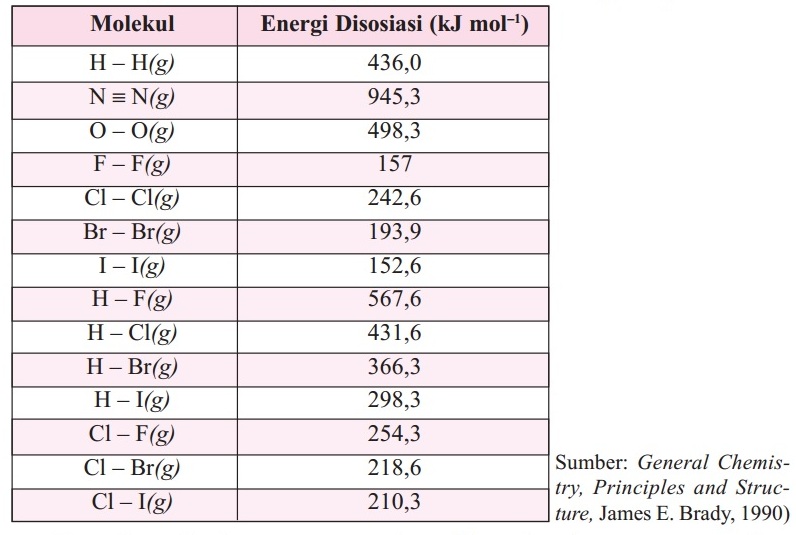
Energi ikatan adalah energi yang dibutuhkan untuk memutuskan 1 ikatan kimia dalam suatu molekul menjadi atom-atomnya. Perubahan entalpi reaksi menggunakan data energi ikatan dirumuskan sebagai berikut: